金屬腐蝕是由金屬在離子化傾向的水溶液中成為離子的難易度決定的。金屬的離子化傾向以標準電極電位表示。標準電極電位是以氫離子(H)為基準,離子化傾向強的金屬易于溶解,即易于腐蝕,其標準電極電位取負值,稱為“普通金屬”。而離子化傾向低的金屬難于溶解,即耐腐蝕,其標準電極電位取為正值,稱為“耐腐蝕金屬”。金屬電離成為離子,在其表面就會進行電化學(xué)反應(yīng)。
以鐵為例,鐵與附著在其表面上的水(H2O)和氧(O2)進行反應(yīng),則生成氫氧化鐵[Fe(OH)2],進一步反應(yīng)成為Fe(OH)3,這就是顯而易見的紅色鐵銹。
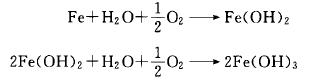
鐵(Fe)從金屬原子結(jié)晶晶格中脫離而成為鐵離子(Fe+)。在溶液中進行移動反應(yīng)(陽極氧化反應(yīng)),同時在溶液中溶解的氧接受了游離的電子(e-)成為氫氧化物的離子(陰極還原反應(yīng)),反應(yīng)用下式表示:
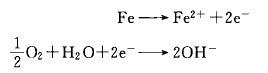
酸性溶液中,氫離子(H+)因為濃度高(pH值低),接受游離的電子(e-),反應(yīng)生成氫(H2)。
![]()
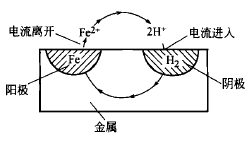
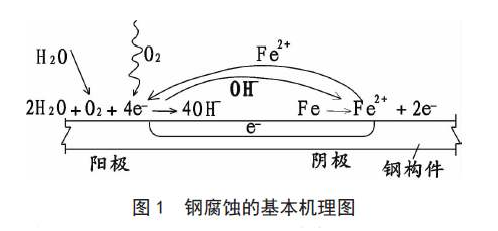
這種陽極反應(yīng)和陰極反應(yīng)相組合進行的腐蝕機理,如圖所示。
金屬腐蝕的評級標準:
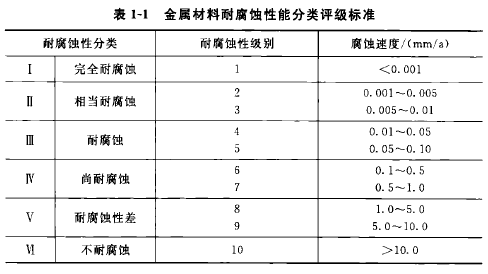
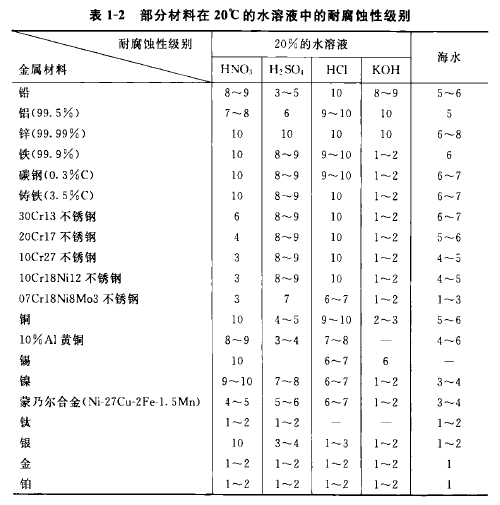
金屬的耐腐蝕性能與金屬的其他性能一樣,表明金屬材料的耐腐蝕性時,必須明確地說明其外界條件,如化學(xué)介質(zhì)的成分、溫度、流速等,然后用腐蝕速度的高低來區(qū)別耐腐蝕性能的高低。腐蝕速度用單位時間內(nèi)單位面積金屬材料的損失量來表示;也可用單位時間內(nèi)金屬材料的腐蝕深度來表示。表1-1列出了工業(yè)上常用的六類10級的耐腐蝕性評級標準;表1-2列出了一些金屬材料的耐腐蝕性。
如果在使用過程中要求保持鏡面或尺寸精密的設(shè)備,應(yīng)選用1~3級的不銹鋼;要求長期不漏或要求使用年限的設(shè)備,應(yīng)選用2~5級;對于檢修方便或壽命無需很長的設(shè)備,可選用4~7級的不銹鋼。對于年腐蝕率超過1mm的一般不選用。
免責(zé)聲明:本網(wǎng)站所轉(zhuǎn)載的文字、圖片與視頻資料版權(quán)歸原創(chuàng)作者所有,如果涉及侵權(quán),請第一時間聯(lián)系本網(wǎng)刪除。

官方微信
《中國腐蝕與防護網(wǎng)電子期刊》征訂啟事
- 投稿聯(lián)系:編輯部
- 電話:010-62313558-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網(wǎng)官方QQ群:140808414





