《AM》: 堅(jiān)固、生物相容和抗疲勞的導(dǎo)電水凝膠涂層
2023-06-30 16:32:12
作者:材料PLUS 來(lái)源:材料PLUS
分享至:
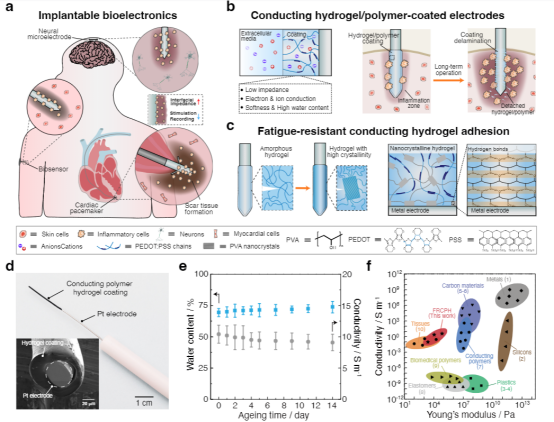
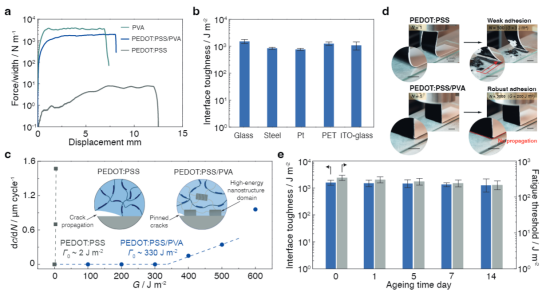
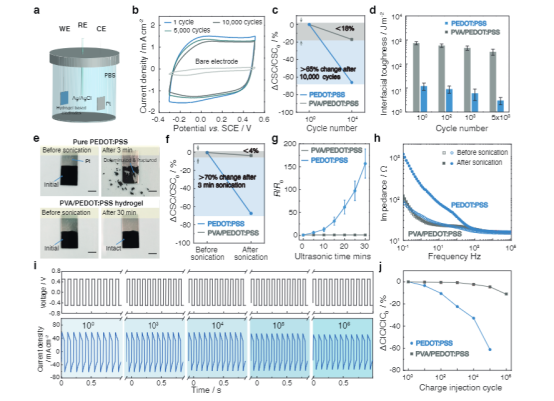
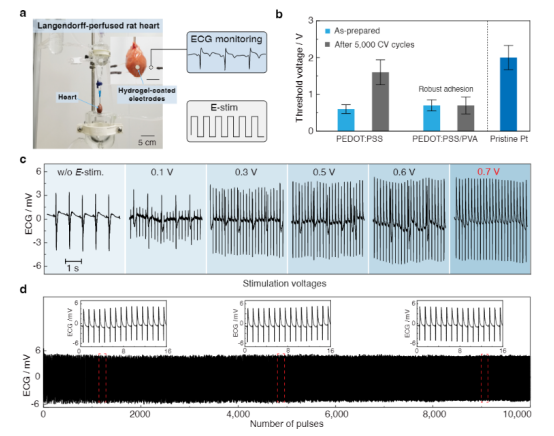
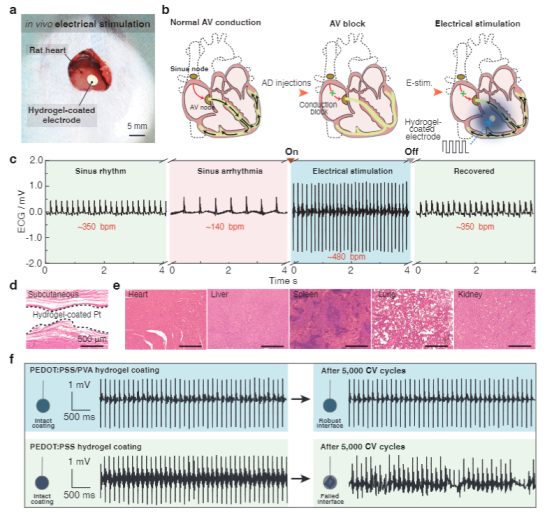
先進(jìn)的可植入生物電子學(xué)在生物界面提供長(zhǎng)期有效的功能方面具有革命性的潛力,使診斷和治療各種疾病和疾病的能力成為可能。這種生物電子技術(shù)需要無(wú)縫集成到人類(lèi)皮膚、組織甚至重要器官的表面,其中界面提供柔軟的機(jī)械耦合并促進(jìn)有效的電/光/熱/化學(xué)交換。盡管生物電子學(xué)最近取得了進(jìn)展,但仍然很難實(shí)現(xiàn)長(zhǎng)期機(jī)械堅(jiān)固和順應(yīng)的傳統(tǒng)金屬電極的植入。此外,長(zhǎng)期植入金屬生物電極通常會(huì)觸發(fā)炎癥反應(yīng),例如在植入物周?chē)e聚具有代謝活性的炎癥細(xì)胞或神經(jīng)膠質(zhì)細(xì)胞,并將植入物包裹在無(wú)血管的膠原組織中,從而大大削弱界面的電/光/熱/化學(xué)交換效率。因此,這一限制對(duì)植入物的快速創(chuàng)新和長(zhǎng)期可靠性構(gòu)成了實(shí)質(zhì)性的障礙。由聚吡咯(PPy)、聚苯胺(PANI)和聚(3,4-乙二氧基噻吩基)-聚苯乙烯磺酸鹽(PEDOT:PSS)等導(dǎo)電聚合物制成的水凝膠,由于其固有的柔軟、濕潤(rùn)、優(yōu)異的機(jī)械柔韌性和電化學(xué)穩(wěn)定性,已成為一種很有前途的電極涂層材料。尤其是,基于PEDOT:PSS的導(dǎo)電聚合物水凝膠由于其獨(dú)特的雙重導(dǎo)電性(電性和離子導(dǎo)電性)和良好的生物相容性而引起了極大的關(guān)注。然而,PEDOT:PSS基電極或器件與生物組織的長(zhǎng)期接觸帶來(lái)了挑戰(zhàn)和挑戰(zhàn)。例如極低的延伸性(斷裂應(yīng)變?yōu)?sim;2%)和極低的韌性(∼500 kJ m−3),這是因?yàn)楦籔EDOT域的固有脆性。這種方法的目標(biāo)是(i)提供與生物組織/器官類(lèi)似的界面物理化學(xué)和電化學(xué)性質(zhì),(ii)實(shí)現(xiàn)高效和雙向的生物界面,以及(iii)在不影響生物植入物功能的情況下緩解異物反應(yīng)。然而,一個(gè)關(guān)鍵的限制來(lái)自于在長(zhǎng)期的電界面連接過(guò)程中由電荷注入/噴射引起的重復(fù)體積膨脹/收縮,這進(jìn)一步增加了導(dǎo)電聚合物/水凝膠涂層對(duì)疲勞裂紋擴(kuò)展和/或分層的敏感性。盡管已經(jīng)開(kāi)發(fā)了一些策略來(lái)在PEDOT:PSS導(dǎo)電聚合物水凝膠和金屬電極之間構(gòu)建堅(jiān)固的界面,通常依賴(lài)于功能性EDOT單體的化學(xué)錨定或PSS聚合物鏈形成雙重網(wǎng)絡(luò),實(shí)現(xiàn)長(zhǎng)期的穩(wěn)健性仍然具有挑戰(zhàn)性。因此,人們對(duì)開(kāi)發(fā)一種關(guān)鍵的使能技術(shù)來(lái)設(shè)計(jì)導(dǎo)電水凝膠涂層引起了廣泛的興趣,這些涂層具有優(yōu)異的電學(xué)性能和長(zhǎng)期的電化學(xué)和機(jī)械穩(wěn)定性,用于生物電子學(xué)、電子皮膚、個(gè)性化醫(yī)學(xué)和腦機(jī)接口。近日,南方科技大學(xué)劉吉團(tuán)隊(duì)提出了一種普遍而可靠的方法來(lái)實(shí)現(xiàn)導(dǎo)電聚合物水凝膠涂層在傳統(tǒng)金屬生物電極上的抗疲勞附著力,方法是在水凝膠涂層和金屬襯底之間的界面上設(shè)計(jì)納米晶結(jié)構(gòu)域。由此得到的導(dǎo)電聚合物水凝膠涂層具有優(yōu)異的機(jī)械穩(wěn)定性,允許在長(zhǎng)期電氣接口期間進(jìn)行多循環(huán)電荷注入/噴射。此外,在生物電極表面引入導(dǎo)電聚合物水凝膠涂層有效地改善了生物相容性,緩解了宿主的反應(yīng),并在金屬電極和生物組織之間提供了一個(gè)機(jī)械順應(yīng)性的生物界面。還成功地展示了抗疲勞導(dǎo)電水凝膠涂層在傳統(tǒng)金屬電極上用于心臟起搏的潛在應(yīng)用。這種應(yīng)用不僅有效地降低了起搏閾值電壓,而且還提高了耐疲勞導(dǎo)電水凝膠涂層的電刺激效果。通過(guò)克服傳統(tǒng)植入生物電極的這些關(guān)鍵缺點(diǎn),這種方法為下一代生物接口技術(shù)奠定了基礎(chǔ)。該研究工作以題為“Mechanically-compliant Bioelectronic Interfaces through Fatigue-resistant Conducting Polymer Hydrogel Coating”的論文發(fā)表在國(guó)際頂級(jí)期刊《Advanced Materials》上。圖1|具有耐疲勞水凝膠涂層的機(jī)械順應(yīng)性生物電子接口的設(shè)計(jì)該研究采用聚乙烯醇(PVA)水凝膠作為模型材料體系,因其能夠輕松形成結(jié)晶度可調(diào)的納米結(jié)構(gòu),如納米晶區(qū)或納米纖維。首先,通過(guò)將聚合物溶液浸漬到固體基材上(如玻璃),形成低結(jié)晶度的PEDOT:PSS/PVA水凝膠。隨后,將PEDOT:PSS/PVA涂層風(fēng)干,顯著提高其結(jié)晶度并增強(qiáng)PVA聚合物鏈與固體基材的親和力。在去離子水中浸泡后,PEDOT:PSS/PVA聚合物涂層可在約10分鐘內(nèi)轉(zhuǎn)變?yōu)樗z涂層。隨后的熱處理過(guò)程進(jìn)一步誘導(dǎo)有序納米晶區(qū)與固體襯底之間的氫鍵形成,從而形成強(qiáng)大的粘附界面。作為對(duì)照,使用傳統(tǒng)的旋涂法在固體基材上制備了PEDOT:PSS導(dǎo)電水凝膠涂層,并進(jìn)行額外的熱處理以提高界面粘附性并增加PEDOT:PSS結(jié)構(gòu)域的結(jié)晶度。圖2|導(dǎo)電聚合物水凝膠涂層的界面穩(wěn)定性為了評(píng)估PEDOT:PSS/PVA水凝膠涂層在各種基材上的粘合性能,研究人員進(jìn)行了90°剝離測(cè)試以測(cè)量界面韌性。自旋涂覆的PEDOT:PSS薄膜顯示出極低的界面韌性(8 J m−2),并且由于PEDOT:PSS聚合物鏈與玻璃基板之間的弱相互作用,很容易分離。相比之下,PEDOT:PSS/PVA-玻璃接頭的界面韌性明顯更高,達(dá)到1800 J m−2,PEDOT:PSS/PVA與其他固體基材(如不銹鋼、Pt、PET和ITO-PET)之間的粘附接頭也明顯更高。純PEDOT:PSS水凝膠涂層在PEDOT:PSS水凝膠內(nèi)部(粘接失效)和粘附界面(粘接失效)都發(fā)生了失效,而在PEDOT:PSS/PVA水凝膠涂層內(nèi)部發(fā)生了明顯的粘接失效。因此,PVA水凝膠網(wǎng)絡(luò)的結(jié)合對(duì)于實(shí)現(xiàn)導(dǎo)電水凝膠和固體基質(zhì)之間的牢固粘附至關(guān)重要。此外,PEDOT:PSS/PVA水凝膠涂層表現(xiàn)出優(yōu)異的穩(wěn)定性,在PBS緩沖液中浸泡14天后,界面韌性和界面疲勞閾值保持一致,與含水量和電導(dǎo)率不變一致。圖3|PEDOT:PSS/PVA水凝膠涂層的電化學(xué)穩(wěn)定性研究評(píng)估了Pt基板上的PEDOT:PSS/PVA水凝膠涂層在多循環(huán)充放電處理過(guò)程中的電化學(xué)性能變化,模擬了通過(guò)那些生物醫(yī)學(xué)設(shè)備(如心臟起搏器)的電極進(jìn)行長(zhǎng)期電刺激時(shí)可逆電荷注入/排出的過(guò)程。對(duì)于通過(guò)自旋涂層制備的PEDOT: PSS涂層Pt電極,觀察到在10,000循環(huán)充放電過(guò)程中電化學(xué)性能逐漸惡化,導(dǎo)致電荷存儲(chǔ)能力(CSC)下降65%。這種惡化可歸因于疲勞引起的PEDOT:PSS涂層的結(jié)構(gòu)解體和分層,因?yàn)橹貜?fù)的體積膨脹/收縮過(guò)程,正如PEDOT:PSS涂層的形貌變化所證明的那樣。相比之下,PEDOT:PSS/PVA水凝膠涂層的電化學(xué)性能在10,000循環(huán)充放電過(guò)程中保持穩(wěn)定,CV曲線略有變化。1萬(wàn)周期治療前后,CSC下降18%;界面形態(tài)保持不變。還進(jìn)行了90度剝離試驗(yàn),以定量評(píng)估涂層界面堅(jiān)固性的演變,結(jié)果顯示PEDOT:PSS/PVA涂層的界面韌性略有下降。此外,還發(fā)現(xiàn)了納米晶結(jié)構(gòu)域的錨定可以有效地提高導(dǎo)電水凝膠涂層的力學(xué)和電化學(xué)穩(wěn)定性,從而滿足植入生物電極的長(zhǎng)期魯棒性和可靠性要求。圖4|Langendorff灌流心臟模型心臟起搏用導(dǎo)電聚合物水凝膠涂層電極 為了評(píng)估強(qiáng)導(dǎo)電性水凝膠涂層對(duì)心功能干擾的診斷和治療效果,采用Langendorff儀灌注大鼠心臟模型。為此,使用化學(xué)接枝技術(shù)將聚(丙烯酸- N -羥基丁二酰亞胺丙烯酸酯)(聚(AA-NHS))的粘合聚合物刷引入PEDOT:PSS/PVA水凝膠涂層上,以便將平面電極牢固地附著在潮濕的心臟表面上。然后將起搏探頭置于左心室,起搏電壓逐漸升高至0.7 V,直到成功捕獲,表明起搏和自主心率同步。廣泛證實(shí),在長(zhǎng)期電起搏過(guò)程中,導(dǎo)電水凝膠涂層的反復(fù)體積膨脹/收縮會(huì)導(dǎo)致疲勞裂紋形成和/甚至涂層分層,進(jìn)一步惡化心電信號(hào)記錄和起搏效果。由于PEDOT:PSS/PVA水凝膠涂層與心臟組織之間具有機(jī)械柔韌的生物界面,以及水凝膠與金屬電極之間具有抗疲勞的界面,起搏閾值電壓保持不變。相反,由于界面分層和結(jié)構(gòu)解體, PEDOT:PSS涂層Pt電極的起跳閾值電壓從0.6 V大幅增加到1.6 V,接近裸Pt電極的起跳閾值電壓。同樣,PEDOT:PSS/PVA水凝膠涂層的長(zhǎng)期心臟起搏能力在灌注大鼠心臟模型10000周期起搏中得到證實(shí),心電圖模式變化很小。相比之下,PEDOT:PSS水凝膠涂層的ECG信號(hào)逐漸惡化。這些發(fā)現(xiàn)進(jìn)一步證明了導(dǎo)電水凝膠涂層的耐久性及其與心臟組織建立密切保形接觸的能力。圖5|導(dǎo)電聚合物水凝膠涂層生物電極體內(nèi)治療房室傳導(dǎo)阻滯高級(jí)房室(AV)傳導(dǎo)阻滯對(duì)應(yīng)于從心房到心室的沖動(dòng)的中斷,因?yàn)樾呐K系統(tǒng)的功能損傷,這通常用電起搏來(lái)治療。在金屬電極上引入機(jī)械順應(yīng)性和抗疲勞性導(dǎo)電水凝膠涂層有望緩解界面阻抗不匹配和宿主反應(yīng),并延長(zhǎng)電起搏的長(zhǎng)期可靠性。為了驗(yàn)證用于心臟電起搏的PEDOT:PSS/PVA水凝膠涂層電極的潛力,使用全心臟大鼠模型進(jìn)行了體內(nèi)研究。證實(shí)了PEDOT:PSS/PVA水凝膠涂層Pt電極成功地為動(dòng)物模型的起搏提供了心外膜刺激。移除電起搏導(dǎo)致心率和節(jié)律恢復(fù)到其原始狀態(tài)。此外,對(duì)主要器官(包括心臟、肝臟、脾臟、肺和腎臟)的進(jìn)一步組織學(xué)分析顯示,使用該導(dǎo)電水凝膠涂層電極的體內(nèi)起搏沒(méi)有引起副作用。類(lèi)似于使用Langendorff裝置的體外模型研究,還測(cè)試了導(dǎo)電水凝膠涂層電極在PBS緩沖液中進(jìn)行5000次循環(huán)充電/放電處理后的起搏功效,以加速導(dǎo)電水凝膠涂層和界面的老化。對(duì)于PEDOT:PSS/PVA水凝膠涂覆的Pt電極,在重復(fù)充放電處理之前和之后,ECG特性表現(xiàn)出顯著的一致性,證實(shí)了抗疲勞PEDOT:PSS/PVA水凝膠涂層的優(yōu)異穩(wěn)定性。這些發(fā)現(xiàn)表明PEDOT:PSS/PVA水凝膠涂層成功地降低了起搏閾值電壓并增強(qiáng)了體內(nèi)電刺激的功效。該研究提出了一種簡(jiǎn)單而可靠的策略,通過(guò)將水凝膠納米結(jié)構(gòu)粘合到固體基材上來(lái)設(shè)計(jì)具有抗疲勞導(dǎo)電水凝膠涂層的電極。由此產(chǎn)生的粘合接頭表現(xiàn)出高達(dá) 330 J m−2 的界面疲勞閾值。該研究的創(chuàng)新方法能夠在金屬生物電極上開(kāi)發(fā)持久的水凝膠涂層,在生物組織和金屬電極之間提供機(jī)械順應(yīng)性、導(dǎo)電性和生物相容性的界面。通過(guò)廣泛的離體和體內(nèi)研究,證明了鉑電極上的抗疲勞導(dǎo)電水凝膠涂層可以有效降低起搏閾值電壓并增強(qiáng)心臟起搏的功效,而不會(huì)導(dǎo)致界面惡化。該研究的制造策略不僅為構(gòu)建長(zhǎng)期且穩(wěn)健的組織生物電子學(xué)接口提供了實(shí)用的解決方案,而且還解決了植入生物電子學(xué)中長(zhǎng)期存在的壽命挑戰(zhàn)。此外,該研究結(jié)果對(duì)生物電子設(shè)備的進(jìn)步具有重要意義,并為未來(lái)改進(jìn)生物醫(yī)學(xué)應(yīng)用鋪平了道路。
免責(zé)聲明:本網(wǎng)站所轉(zhuǎn)載的文字、圖片與視頻資料版權(quán)歸原創(chuàng)作者所有,如果涉及侵權(quán),請(qǐng)第一時(shí)間聯(lián)系本網(wǎng)刪除。