【引言】
軟骨和皮膚的含水量雖大于50%但仍很堅硬且強(qiáng)韌,遠(yuǎn)遠(yuǎn)超過目前已有的合成水凝膠。近來關(guān)于強(qiáng)韌水凝膠的制備取得了較大的進(jìn)展,例如雙網(wǎng)絡(luò)水凝膠的韌性達(dá)到了皮膚的水平,而無機(jī)-有機(jī)復(fù)合材料則表現(xiàn)出了更好的性能。但是這些材料的韌性得益于高延展性,而硬度則仍無法與天然組織相媲美。
【成果簡介】
近日,德國多特蒙德工業(yè)大學(xué)的Joerg C. Tiller1(通訊作者)等人通過酶引發(fā)在聚合物水凝膠中形成了均勻分散的無定型磷酸鈣納米結(jié)構(gòu)。該水凝膠在溶脹平衡時的斷裂能可達(dá)到1300J/m2,高于目前所知的任何一種合成水凝膠。其彈性模量達(dá)到了440MPa,遠(yuǎn)遠(yuǎn)高于軟骨和皮膚。另外,這種高充填復(fù)合材料可以被設(shè)計成透明的且保持其原有的延展性,即使是有缺口存在的條件下仍能保持較高延展性。該研究團(tuán)隊發(fā)現(xiàn)透析可以調(diào)控該均勻礦化水凝膠的機(jī)械性能,尤其是硬度。該成果以“Enzymatic mineralization generates ultrastiff and tough hydrogels with tunable mechanics”為題于2017年3月1日發(fā)表在期刊Nature上。
【圖文導(dǎo)讀】
圖1 酶誘導(dǎo)不同聚合物網(wǎng)絡(luò)體鈣化
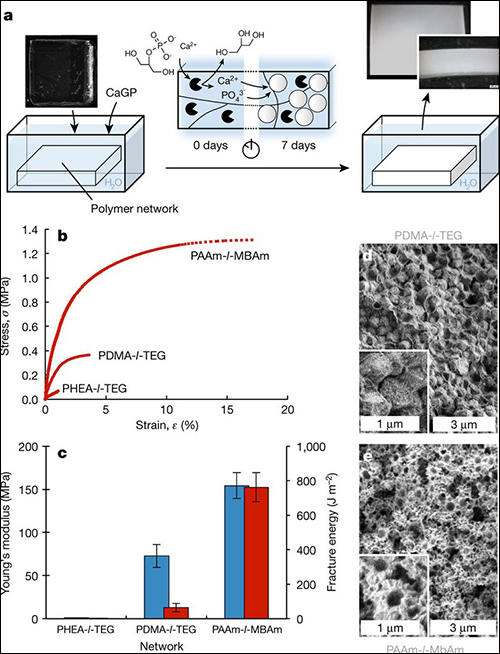
a)PDMA-l-TEG網(wǎng)絡(luò)的鈣化過程。制備了三種具有不同聚合物網(wǎng)絡(luò)(PHEA-l-TEG, PDMA-l-TEG和PAAm-l-MBAm)的薄膜,通過光聚合引入了堿性磷酸酶。然后加入2-甘油磷酸鈣(CaGP)鈣化溶液。隨著時間的增加,酶催化CaGP的脫磷酸作用,將鈣離子和磷酸根留在聚合物網(wǎng)絡(luò)中,呈無定型結(jié)構(gòu)(圖中白色圓圈)。這些薄膜由透明變?yōu)槿榘咨砻靼l(fā)生了礦化作用;
b)PHEA-l-TEG, PDMA-l-TEG和PAAm-l-MBAm網(wǎng)絡(luò)的應(yīng)力-應(yīng)變曲線;
c)三種網(wǎng)絡(luò)的最大楊氏模量(藍(lán)色)和斷裂能(紅色),這些實驗至少有三個平行樣,所有數(shù)據(jù)都是平均值,誤差線代表標(biāo)準(zhǔn)偏差。
d)PDMA-l-TEG網(wǎng)絡(luò)鈣化7天后的斷面掃描電鏡照片;
e)PAAm-l-MBAm網(wǎng)絡(luò)鈣化7天后的斷面掃描電鏡照片。
圖2 酶和無機(jī)基質(zhì)在水凝膠中的分布
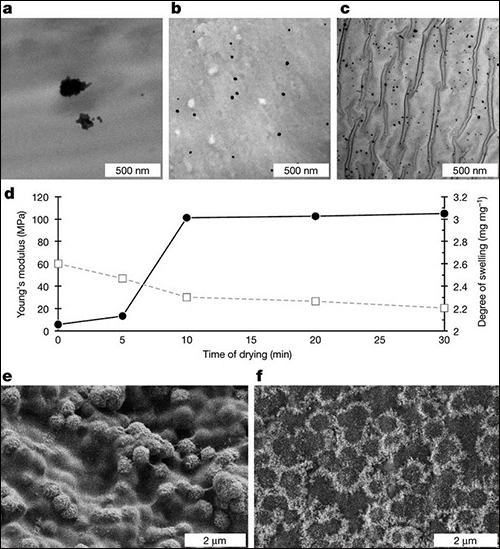
含0.4wt%固定堿性磷酸酶鍍銀水凝膠在礦化之前的透射電鏡照片:
a)PHEA-l-TEG;b)PDMA-l-TEG;c)PAAm-l-MBAm;
d)PAAm-l-MBAm礦化3天后的楊氏模量(黑線)和溶脹度(灰色虛線)測量值;
e)PDMA-l-TEG礦化7天后的掃描電鏡照片;
f)PAAm-l-MBAm礦化3天后的掃描電鏡照片。
圖3 含水復(fù)合水凝膠的力學(xué)性能
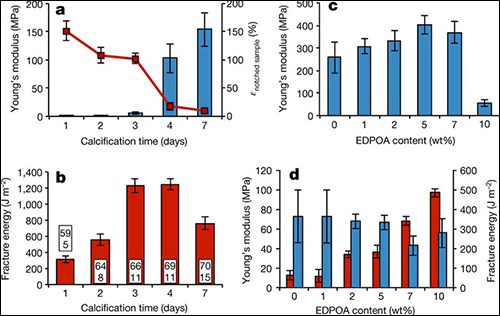
a)在室溫下鈣化的PAAm-l-MBAm的楊氏模量(柱狀圖)和缺口試樣的斷裂應(yīng)力(紅線);
b)相應(yīng)的PAAm-l-MBAm復(fù)合物的斷裂能(柱狀圖),其中無機(jī)組分(磷酸鈣,CaP)的含量標(biāo)注在柱狀內(nèi)部,干燥狀態(tài)(上)用質(zhì)量分?jǐn)?shù)表示,溶脹狀態(tài)(下)用體積分?jǐn)?shù)表示;
c)含EDPOA的PDMA-l-TEG復(fù)合物礦化7天后的楊氏模量;
d)含EDPOA的PDMA-l-TEG復(fù)合物的斷裂能(紅色)和楊氏模量(藍(lán)色),鈣化時間:0wt%和7wt% EDPOA為4天,1wt%,2wt%和5wt%EDPOA為3天,10wt%EDPOA為7天。這些實驗至少有三個平行樣,所有數(shù)據(jù)都是平均值,誤差線代表標(biāo)準(zhǔn)偏差。
圖4 超硬透明復(fù)合水凝膠

室溫下礦化7天的含a)1wt%;b)2wt%;c)10wt%EDPOA的溶脹PDMA-l-TEG網(wǎng)絡(luò),下面對應(yīng)的是各自的掃描電鏡照片(大圖)和選區(qū)電子衍射照片(小圖);
含10wt%EDPOA的PDMA-l-TEG網(wǎng)絡(luò)在d)水中;e)鈣化溶液中溶脹7天;
f)圓圈狀的含2wt%EDPOA的溶脹PDMA-l-TEG鈣化7天后,可以承載100g。
【小結(jié)】
除磷酸鈣之外,該研究同樣適用于葡萄糖-6-磷酸鹽,并且這種復(fù)合材料具有很好的生物相容性,因此這種方法可以被用于體內(nèi)生成力學(xué)性能可調(diào)控的移植體,例如,組織工程中用于再生藥物和細(xì)胞生長的堅硬支架,或者強(qiáng)韌植入體和藥物釋放體系。
更多關(guān)于材料方面、材料腐蝕控制、材料科普等方面的國內(nèi)外最新動態(tài),我們網(wǎng)站會不斷更新。希望大家一直關(guān)注中國腐蝕與防護(hù)網(wǎng)http://www.ecorr.org
責(zé)任編輯:劉洋
投稿聯(lián)系:編輯部
電話:010-62313558-806
郵箱:fsfhzy666@163.com
中國腐蝕與防護(hù)網(wǎng)官方 QQ群:140808414
免責(zé)聲明:本網(wǎng)站所轉(zhuǎn)載的文字、圖片與視頻資料版權(quán)歸原創(chuàng)作者所有,如果涉及侵權(quán),請第一時間聯(lián)系本網(wǎng)刪除。

官方微信
《中國腐蝕與防護(hù)網(wǎng)電子期刊》征訂啟事
- 投稿聯(lián)系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護(hù)網(wǎng)官方QQ群:140808414





