黃發(fā),王儉秋,韓恩厚,柯偉
金屬腐蝕與防護(hù)國(guó)家重點(diǎn)實(shí)驗(yàn)室,中國(guó)科學(xué)院金屬研究所,沈陽(yáng) 110016
Email: wangjianqiu@imr.ac.cn

作者簡(jiǎn)介
黃 發(fā),女,博士生,漢族,1985年10月出生于湖北省隨州市。2008年6月畢業(yè)于中國(guó)礦業(yè)大學(xué)材料科學(xué)與工程學(xué)院,獲工學(xué)學(xué)士學(xué)位。同年9月保送進(jìn)入中國(guó)科學(xué)院金屬研究所攻讀碩士學(xué)位,并于2010年9月提前攻讀博士學(xué)位,師從王儉秋研究員。主要研究方向?yàn)殒嚮辖鹪诟邷馗邏核h(huán)境中的腐蝕與應(yīng)力腐蝕行為。2009年9月,論文“鑄造AZ91鎂合金在CO32-/HCO3-體系中的應(yīng)力腐蝕行為”在第十一屆全國(guó)青年腐蝕與防護(hù)科技論文講評(píng)會(huì)中被評(píng)為一等獎(jiǎng)。2011年4月,在第二屆核電站材料與可靠性國(guó)際研討會(huì)上做英文報(bào)告“Short-time oxidation of Alloy 690 in high-temperature and high-pressure steam and water”。2011年8月,論文“pH值對(duì)690合金在NaCl環(huán)境中電化學(xué)行為的影響”獲第六屆全國(guó)腐蝕大會(huì)優(yōu)秀論文特等獎(jiǎng)。
摘 要:用動(dòng)電位極化曲線、電化學(xué)阻抗譜(EIS)與Mott-Schottky曲線研究了690合金在不同pH值的NaCl溶液環(huán)境中的電化學(xué)行為,并結(jié)合電位-pH圖分析了腐蝕產(chǎn)物與電化學(xué)行為之間的關(guān)系。結(jié)果表明,pH值對(duì)690合金在NaCl溶液中的極化行為影響較大。在較低pH值的NaCl溶液中(4.98-10.68),690合金的極化曲線出現(xiàn)明顯的二次鈍化,而在更高pH值下,690合金在低電位下(0~0.6 V)體現(xiàn)活性溶解的特征,在高電位下(0.7~1.2 V)出現(xiàn)鈍化。同時(shí)發(fā)現(xiàn),隨著pH值的升高,690合金在0.2866 V下陽(yáng)極極化鈍化膜發(fā)生從n型向p型的轉(zhuǎn)變。在pH=8.10的NaCl溶液中,690合金表面生成的鈍化膜的膜層電阻最大,載流子密度最小,保護(hù)性能最好。
關(guān)鍵詞:Alloy 690;鈍化膜;動(dòng)電位極化;電化學(xué)阻抗譜;Mott-Scottky曲線
1 引言
資助信息:國(guó)家重點(diǎn)基礎(chǔ)研究發(fā)展計(jì)劃項(xiàng)目(2011CB610502)和國(guó)家自然科學(xué)基金項(xiàng)目(51025104)資助。
蒸汽發(fā)生器位于壓水堆核電站一二回路的交界處,其正常運(yùn)行直接關(guān)系到核電系統(tǒng)的安全性與經(jīng)濟(jì)性。上世紀(jì)六十年代,人們選用鎳基600合金 (Ni-16Cr-9Fe)作為蒸汽發(fā)生器的傳熱管材,但長(zhǎng)期運(yùn)行過(guò)程中卻發(fā)現(xiàn)600合金對(duì)點(diǎn)蝕、應(yīng)力腐蝕和晶間腐蝕十分敏感[1,2]。后來(lái),人們采用Cr含量更高的690合金(Ni-30Cr-10Fe)來(lái)代替600合金。Cr含量的增加,極大地提高了690合金在核電水化學(xué)環(huán)境中的耐蝕性能[3]。然而,690合金在含有氯鹽、硫代硫酸鹽的堿性環(huán)境中依然具有很高的點(diǎn)蝕和沿晶應(yīng)力腐蝕敏感性[4,5]。而且,蒸汽發(fā)生器管材的失效部位多位于支撐板的熱交換縫隙中,盡管給水中的雜質(zhì)離子濃度很低,但一些雜質(zhì)離子,如Na+,SO42-,Cl- 等通過(guò)沸騰過(guò)程濃縮,在縫隙中的濃度可以達(dá)到正常值的106倍[6],形成高腐蝕性的局部環(huán)境,加速蒸汽發(fā)生器管材的腐蝕。
人們對(duì)鎳基合金在高溫高壓水環(huán)境中的腐蝕行為展開(kāi)了廣泛研究[7,8],但腐蝕性離子存在的條件下的腐蝕行為研究相對(duì)較少[9]。高溫高壓水環(huán)境中的腐蝕是液相反應(yīng),從本質(zhì)上來(lái)講是電化學(xué)過(guò)程[10],運(yùn)用電化學(xué)方法原位研究690合金的腐蝕行為具有重要意義。Chen等人[5,11]采用循環(huán)極化和慢應(yīng)變速率拉伸法研究了pH值、Cl- 濃度與溫度對(duì)690合金在NaCl環(huán)境中的腐蝕行為的影響,但相應(yīng)的影響機(jī)理仍不清楚。
本文采用動(dòng)電位極化曲線、電化學(xué)阻抗譜(EIS)和半導(dǎo)體電容分析方法研究了690合金在不同pH值的NaCl溶液環(huán)境中的電化學(xué)行為,并結(jié)合電位-pH圖分析了腐蝕產(chǎn)物與電化學(xué)行為之間的關(guān)系。
2 實(shí)驗(yàn)方法
2.1 實(shí)驗(yàn)材料
實(shí)驗(yàn)材料為美國(guó)EPRI公司提供的690合金管材,其化學(xué)成分(質(zhì)量分?jǐn)?shù),%)為:Ni 59.20,Cr 29.02,F(xiàn)e 10.28,Si 0.31,Mn 0.30,Ti 0.30,Al 0.16,C 0.018,Co 0.015,Cu 0.01,P 0.009,S 0.001。管材沿縱截面切開(kāi)壓平后,經(jīng)715 oC × 2 h退火處理,以去除冷加工殘余應(yīng)力的影響。電化學(xué)實(shí)驗(yàn)樣品經(jīng)SiC砂紙逐級(jí)打磨至1500#,工作面積約為100 mm2,非工作面用環(huán)氧樹(shù)脂密封。
2.2 腐蝕環(huán)境
實(shí)驗(yàn)采用5種不同濃度配比的NaCl硼酸緩沖溶液體系,其化學(xué)成分和相應(yīng)的pH值見(jiàn)表1。電化學(xué)實(shí)驗(yàn)溫度為25 oC,實(shí)驗(yàn)前預(yù)先向封閉的電解池中通入高純N2 約1 h,并在整個(gè)實(shí)驗(yàn)過(guò)程中持續(xù)通入N2以去除O2。
表1. H3BO3 / LiOH + NaCl溶液體系濃度配比與pH值變化
| B/Li | H3BO3 (mol/L) |
LiOH (mol/L) |
NaCl (mol/L) |
pH (298 K) |
| 1/0 | 0.10 | 0 | 0.5 | 4.98 |
| 9/1 | 0.09 | 0.01 | 0.5 | 8.10 |
| 1/1 | 0.05 | 0.05 | 0.5 | 10.68 |
| 1/9 | 0.01 | 0.09 | 0.5 | 12.69 |
| 0/1 | 0 | 0.10 | 0.5 | 12.78 |
2.3電化學(xué)實(shí)驗(yàn)方法
采用Potentiostat/Galvanostat Model 273A恒電位儀研究690合金在表1所列溶液體系中的電化學(xué)行為。參比電極為飽和甘汞電極(SCE),輔助電極為鉑片。本文中的所測(cè)電位均已轉(zhuǎn)化為相對(duì)于標(biāo)準(zhǔn)氫電極的電位(SHE)[12]。動(dòng)電位極化前,先將試樣在-0.7134 V下陰極極化10 min以實(shí)現(xiàn)新鮮表面,極化曲線的掃描速率為0.5 mV/s。另取新鮮試樣分別在0.2866 V下陽(yáng)極極化45 min測(cè)量其鈍化膜的電容特性,電化學(xué)阻抗譜的頻率范圍為10 mHz ~ 100 kHz,并用Zsimpwin 軟件分析阻抗數(shù)據(jù),Mott-Schottky曲線的電壓測(cè)試范圍為-0.2134 V ~ 1.2866 V。
3實(shí)驗(yàn)結(jié)果與討論
圖1為690合金在不同pH值的NaCl溶液體系中的極化曲線。可以看出,在較低pH值下(B/Li=1/0,9/1,1/1),690合金的極化曲線體現(xiàn)出明顯的二次鈍化特征。其中,較低電位下的鈍化發(fā)生在 0~0.6 V的電位區(qū)間,記為I區(qū);較高電位下的鈍化發(fā)生在 0.7~1.2 V的電位區(qū)間,記為II區(qū)。而在更高pH值下(B/Li=1/9,0/1),690合金的極化曲線在電位I區(qū)表現(xiàn)出活性溶解的特征,電位II區(qū)同樣出現(xiàn)鈍化。同時(shí)發(fā)現(xiàn),690合金在B/Li=9/1的溶液體系中的二次鈍化(II區(qū))效果最好。
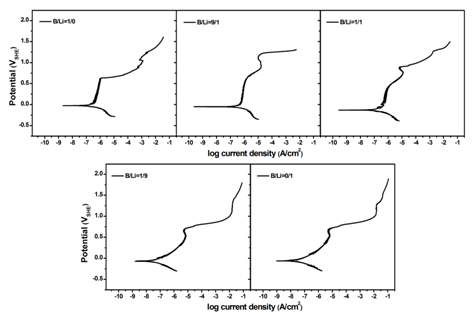
圖1. 690合金在不同pH值的NaCl溶液中的極化曲線
圖2為690合金在五種不同pH值的NaCl溶液中于鈍化I區(qū)0.2866 V下陽(yáng)極極化45 min形成的鈍化膜阻抗譜,其對(duì)應(yīng)的等效電路如圖3所示,各電路元件參數(shù)列于表2中。其中,Rs為溶液電阻,Cdl代表雙電層電容,Rt為電荷傳遞電阻,Cf為膜層電容,Rf為膜層電阻,ndl和nf為彌散指數(shù),分別表示Cdl和Cf偏離理想電容(n=1)的程度。#p#副標(biāo)題#e#
從圖3a和表2可以看出,低pH值下(B/Li=1/0,9/1),雙電層Cdl/Rt和膜層Cf/Rf串聯(lián),且膜層的彌散指數(shù)nf=1,對(duì)應(yīng)的膜層較完整,電荷轉(zhuǎn)移反應(yīng)發(fā)生在鈍化膜外部的溶液中。比較可知,B/Li=9/1體系的膜層電阻Rf高于B/Li=1/0的體系,表明前者的保護(hù)性能更好。同時(shí)發(fā)現(xiàn),前者的反應(yīng)電阻Rt低于后者,可能的原因是產(chǎn)物膜的還原加速了陰極反應(yīng),從而降低了總的反應(yīng)電阻。
從圖3b和表2可以看出,高pH值下(B/Li=1/1,1/9, 0/1),雙電層Cdl/Rt和膜層Cf/Rf并聯(lián),且nf<1,對(duì)應(yīng)的膜層出現(xiàn)孔洞,電荷轉(zhuǎn)移反應(yīng)同時(shí)發(fā)生在鈍化膜的外層和膜下孔洞中。從表2還可以看出,高pH值下的膜層電阻Rf顯著小于低pH值下的膜層電阻,保護(hù)性能下降。
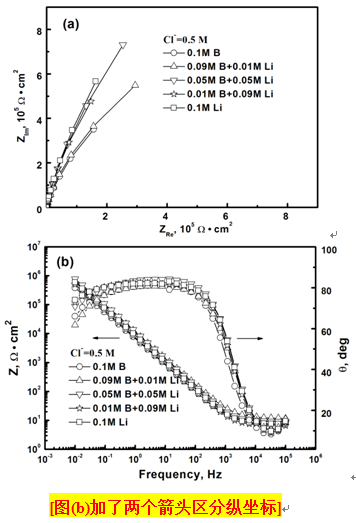
圖2. 690合金在不同pH值的NaCl溶液中陽(yáng)極極化鈍化膜的阻抗譜
根據(jù)Mott-Schottky理論,空間電荷層單位面積電容Csc(F/cm2)的平方值與n型和p型半導(dǎo)體內(nèi)載流子密度之間存在如下關(guān)系[13]:
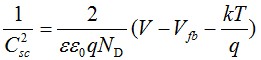 n-type (1)
n-type (1)
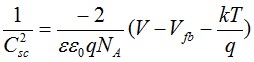 p-type (2)
p-type (2)
式中,ε為鈍化膜的介電常數(shù),ε0為真空介電常數(shù),q為電子電量,ND和NA分別為施主能級(jí)和受主能級(jí)的載流子密度,V為施加的電壓,Vfb為平帶電位,k為Boltzmann常數(shù),T為絕對(duì)溫度。當(dāng)Mott-Schottky曲線的斜率為正值時(shí),對(duì)應(yīng)的鈍化膜表現(xiàn)為n型半導(dǎo)體特性,反之,則為p型半導(dǎo)體特性。
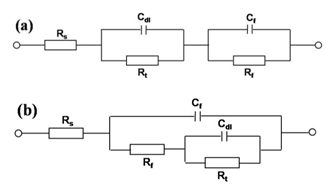
圖3. 690合金陽(yáng)極極化鈍化膜的EIS等效電路
表2. 690合金在不同pH值的NaCl溶液中陽(yáng)極極化鈍化膜的EIS擬合結(jié)果
| B/Li | Rs (ohm) |
Cdl (F) |
ndl | Rt (ohm) |
Cf (F) |
nf | Rf (ohm) |
| 1/0 | 9.13 | 3.47E-5 | 0.89 | 1.31E6 | 2.13E-4 | 1 | 1.16E4 |
| 9/1 | 11.69 | 4.24E-5 | 0.83 | 8.22E4 | 2.59E-5 | 1 | 1.26E6 |
| 1/1 | 7.57 | 6.74E-6 | 1 | 2.02E6 | 8.76E-6 | 0.85 | 3.99 |
| 1/9 | 6.11 | 7.13E-6 | 1 | 4.67E6 | 1.52E-5 | 0.88 | 3.23 |
| 0/1 | 6.53 | 6.34E-6 | 1 | 5.20E6 | 1.26E-5 | 0.87 | 3.42 |
圖4為690合金在不同pH值的NaCl溶液中的Mott-Schottky曲線。0.2866 V處各溶液體系下的Mott-Schottky曲線的斜率分別為k1=8.93E9 (B/Li=1/0)、k2=3.91 (B/Li=9/1)、k3=-3.73E10 (B/Li=1/1)、k4=-2.73E10 (B/Li=1/9)、k5=-3.90E10 (B/Li=0/1)。由于0<k1<k2,故而B(niǎo)/Li=1/0與B/Li=9/1兩種體系下的鈍化膜體現(xiàn)n型半導(dǎo)體特征,且電子載流子的密度Ne1>Ne2,表明后者鈍化膜的致密性優(yōu)于前者。同樣,由于k3, k4, k5<0,故而B(niǎo)/Li=1/1、1/9、0/1體系下生成的鈍化膜體現(xiàn)p型半導(dǎo)體的特征。
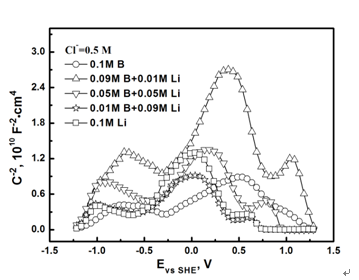
圖4. 690合金在0.5 M NaCl硼酸緩沖溶液中的Mott-Schottky曲線
電化學(xué)阻抗譜與Mott-Schottky曲線的結(jié)果均表明,B/Li=9/1體系中690合金在I區(qū)內(nèi)陽(yáng)極極化生成的鈍化膜保護(hù)性最好。
表3. 690合金在五種溶液體系中鈍化區(qū)間I與II對(duì)應(yīng)的腐蝕產(chǎn)物
| Solution | B/Li=1/0, 9/1 | B/Li=1/1, 1/9, 0/1 | |
| Region I | Ni→Ni2+ | Ni→HNiO2-/Ni3O4/Ni2O3 | |
| Cr→Cr2O3/Cr(OH)mn+ | Cr→CrO42- | ||
| Fe→Fe2O3 | Fe→Fe(OH)n+/FeO42- | ||
| Region II | Ni→Ni2+/NiO2 | Ni→Ni2O3/NiO2 | Ni→NiO2 |
| Cr→CrO42- | Cr→CrO42- | ||
| Fe→Fe(OH)n+/FeO42- | Fe→FeO42- | ||
根據(jù)Ni-Cl-H2O,Cr-H2O,F(xiàn)e-Cl-H2O體系在25 oC的電位-pH圖[14],可以得到690合金在上述五種溶液體系中鈍化區(qū)間I與II對(duì)應(yīng)的理論腐蝕產(chǎn)物,如表3所示。鈍化區(qū)間I內(nèi),低pH值下(B/Li=1/0,9/1),鎳的穩(wěn)定相為Ni2+,鉻和鐵可分別以氧化物Cr2O3和Fe2O3的形式穩(wěn)定存在。其中,F(xiàn)e2O3為n型半導(dǎo)體,點(diǎn)缺陷為間隙Fe2+/Fe3+和氧空位[15]。Cr2O3可為n型也可為p型半導(dǎo)體,取決于載流子的類型[16]。由于該區(qū)間內(nèi)的Mott-Schottky曲線體現(xiàn)出n型半導(dǎo)體特性(圖4),故此兩種溶液環(huán)境中,Cr2O3最有可能體現(xiàn)n型半導(dǎo)體特性。由于此兩種溶液中生成的Fe2O3與Cr2O3具有良好的保護(hù)性,故而腐蝕產(chǎn)物膜的保護(hù)性能較好,這與阻抗譜的測(cè)試結(jié)果相符。高pH值下(B/Li=1/1,1/9,0/1),鎳主要以HNiO2-的形式存在,僅可能生成少量的Ni3O4/Ni2O3型氧化物,鉻和鐵均以離子態(tài)CrO42-和FeO42-的形式存在,故而此時(shí)極化曲線呈現(xiàn)活性溶解特征(圖1),腐蝕產(chǎn)物膜的保護(hù)性能較差(圖3,表2)。#p#副標(biāo)題#e#
鈍化區(qū)間II內(nèi),不同pH值的溶液中,鉻和鐵的氧化物均發(fā)生電化學(xué)溶解生成CrO42-和FeO42-,此時(shí)鎳在高電位下生成的氧化物NiO2和Ni2O3將會(huì)對(duì)690合金起到保護(hù)作用,抑制腐蝕溶解的速率,故而極化曲線在此電位區(qū)間內(nèi)表現(xiàn)二次鈍化的特征(圖1)。
4 結(jié)論
1. 在較低pH值(B/Li=1/0,9/1,1/1)的NaCl溶液中,690合金的極化曲線在0~0.6 V和0.7~1.2 V的電位區(qū)間內(nèi)均出現(xiàn)鈍化。而在高pH值(B/Li=1/9,0/1)的NaCl溶液中,690合金的極化曲線在0~0.6 V的電位區(qū)間內(nèi)則表現(xiàn)出活性溶解的特征,在0.7~1.2 V的電位區(qū)間內(nèi)同樣出現(xiàn)鈍化。
2. 隨著pH值的升高,690合金在0.2866 V下的陽(yáng)極極化鈍化膜發(fā)生從n型(B/Li=1/0, 9/1)向p型(B/Li=1/1, 1/9, 0/1)的轉(zhuǎn)變。在B/Li=9/1的溶液中,690合金的鈍化效果最好,生成的鈍化膜的膜層電阻最大,且致密性最好。
致 謝
感謝美國(guó)電力研究院(EPRI)提供的商業(yè)690合金管材。
References(參考文獻(xiàn))
[1] D. Gómez-Briceno, M.L. Castano, M.S. Carcía. Stress corrosion cracking susceptibility of steam generator tube materials in AVT (all volatile treatment) chemistry contaminated with lead [J]. Nuclear Engineering and Design, 1996, 165(1-2): 161-169.
[2] R.S. Dutta. Corrosion aspects of Ni-Cr-Fe based and Ni-Cu based steam generator tube materials [J]. Journal of Nuclear Materials, 2009, 393: 343-349.
[3] K.H. Lee, G. Cragnolino, D.D. MacDonald. Effect of heat treatment applied potential on the caustic stress corrosion cracking of inconel 600 [J]. Corrosion, 1985, 41: 540.
[4] R.C. Newman, W.P. Wong, H. Ezuber, A. Gamer. Pitting of stainless steels by thiosulfate ions [J]. Corrosion, 1989, 45(4): 282-287.
[5] Y.Y. Chen, L.B. Chou, H.C. Shih. Factors affecting the electrochemical behavior and stress corrosion cracking of Alloy 690 in chloride environments [J]. Materials Chemistry and Physics, 2006, 97: 37-49.
[6] B.T. Lu, J.L. Luo, Y.C. Lu. A mechanistic study on lead-induced passivity-degradation of nickel-based alloy [J]. Journal of the Electrochemical Society, 2007, 154(8): C379-C389.
[7] F. Carette, M.C. Lafont, G. Chatainier, L. Guinard, B. Pieraggi. Analysis and TEM examination of corrosion scales grown on Alloy 690 exposed to pressurized water. Surface and Interface Anaysisl, 2002, 34: 135-138.
[8] J. Panter, B. Viguier, J.M. Cloué, M. Foucault, P. Combrade, E. Andrieu. Influence of oxide films on primary water stress corrosion cracking initiation of Alloy 600 [J]. Journal of Nuclear Materials, 2006, 348: 213-221.
[9] I.J. Yang. Effect of sulphate and chloride ions on the crevice chemistry and stress corrosion cracking of alloy 600 in high temperature aqueous solution [J]. Corrosion Science, 1992, 33(1): 25-29, 31-37.
[10] R.W. Bosch, D. Feron, J.P. Celis. Electrochemistry in Light Water Reactors, Reference Electrodes, Measurement, Corrosion and Tribocorrosion Issues. EFC Publication No. 49, Woodhead Publishing in Materials, Cambridge, UK, 2007
[11] Y.Y. Chen, L.B. Chou, H.C. Shih. Effect of solution pH on the electrochemical polarization and stress corrosion cracking of Alloy 690 in 5 M NaCl at room temperature [J]. Materials Science and Engineering A, 2005, 396: 129-137.
[12] D.D. Macdonald, A.C. Scott, P. Wentrcek. External reference electrodes for use in high temperature aqueous systems [J]. Journal of the Electrochemical Society, 1979, 126(6): 908-911.
[13] J.B. Huang, X.Q. Wu, E.H. Han. Influence of pH on electrochemical properties of passive films formed on Alloy 690 in high temperature aqueous environments [J]. Corrosion Science, 2009, 51: 2976-2982.
[14] C.M. Chen, K. Aral, G.J. Theus. Computer-Calculated Potential pH Diagrams to 300oC, EPRI-Report NP-3137, Electric Power Research Institute, Palo Alto, CA, 1983.
[15] L.A.S. Ries, M.D.C. Belo, M.G.S. Ferreira, I.L. Muller. Chemical composition and electronic structure of passive films formed on Alloy 600 in acidic solution [J]. Corrosion Science, 2008, 50(3):676-686.
M.D.C Belo, N.E. Hakiki, M.G.S. Ferreira. Semiconducting properties of passive films formed on nickel-base alloys type Alloy 600: influence of the alloying elements [J]. Electrochimica Acta, 1999, 44: 2473-2481.
-
標(biāo)簽: Alloy 690, 鈍化膜, 動(dòng)電位極化, 電化學(xué)阻抗譜, Mott-Scottky曲線

官方微信
《中國(guó)腐蝕與防護(hù)網(wǎng)電子期刊》征訂啟事
- 投稿聯(lián)系:編輯部
- 電話:010-62313558-806
- 郵箱:fsfhzy666@163.com
- 中國(guó)腐蝕與防護(hù)網(wǎng)官方QQ群:140808414




