金屬的腐蝕速度與極化作用
文/林玉珍·北京化工大學
在實際中,人們不僅關心金屬設備和材料的腐蝕傾向,更重要的是關心腐蝕過程進行的速度。一個大的腐蝕傾向不一定對應著一個高的腐蝕速度。例如鋁,從熱力學角度看,它的腐蝕傾向很明顯,但在某些介質中,它的腐蝕速度卻極低,比那些腐蝕傾向較小的金屬更耐蝕。可見,腐蝕傾向并不能作為腐蝕速度的尺度。對于金屬設備來說,要設法來降低腐蝕反應的速度,以達到延長其使用壽命的目的。為此,必須了解腐蝕過程的機理,掌握不同條件下腐蝕的動力學規律以及影響腐蝕速度的各種因素,并尋求有效地解決方案。
腐蝕原電池
腐蝕發生的根本原因是由于環境中有氧化劑存在。而在工程中“材料/環境”組成的電極系統,由于種種原因(如材料成份等)使金屬表面各處的電位不相等,統稱為電化學不均勻性,從而形成腐蝕原電池,加速了腐蝕。例如工業鋅,因其中含雜質(如Cu),存在著腐蝕電池,所以它的腐蝕速度要比純鋅大的得多如圖1所示。
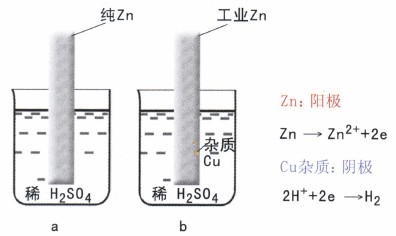
腐蝕電池的工作歷程
腐蝕電池的工作原理與—般原電池相同,如圖2所示。陽極(區)上發生失去電子的氧化反應(陽極反應),電位相對較低,是電池中的負極,也是發生腐蝕的地方。陰極(區)上發生接收電子的還原反應(陰極反應),電位相對較高,是電池中的正極。腐蝕電流Ic的流向是指正電荷流動的方向,電流從陽極流出進入溶液中,再從溶液中流入陰極。
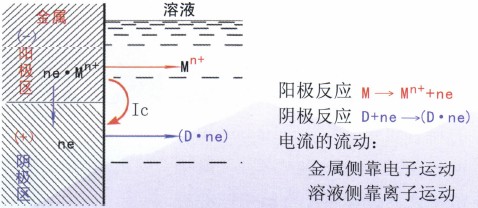
腐蝕電池中,這三部分工作,相互聯系,缺—不可。只要其中任何一個步驟停止,整個電池工作就停止,體系中的金屬腐蝕也就停止。
腐蝕電池的特點
①腐蝕電池是短路的原電池,它將化學能變成電能,但卻不能被利用,而是以熱的形式散失掉了。
②腐蝕電池的存在,只能加速腐蝕,而不是腐蝕發生的根本原因。如果環境中沒有氧化劑存在,即使有腐蝕電池的存在,也不會發生腐蝕。
③根據腐蝕電池中的電極大小,常把腐蝕電池分為宏觀腐蝕電池和微觀腐蝕電池兩類。
極化作用
極化作用及其表征
觀察一個簡化的腐蝕電池的工作,如圖3所示。
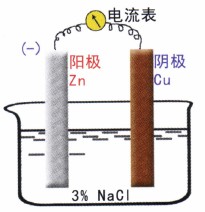
當電池接通的瞬間,可觀察到一個很大的起始電流。根據歐姆定律,其電流為:
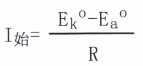 式中Ek°為陰極(銅)的開路電位;Ea°為陽極(鋅)的開路電位;R為電池系統的總電阻。當電流瞬間達到最大值后,隨時間的增長電流卻很快減小,最后穩定在一個較小的電流值。
式中Ek°為陰極(銅)的開路電位;Ea°為陽極(鋅)的開路電位;R為電池系統的總電阻。當電流瞬間達到最大值后,隨時間的增長電流卻很快減小,最后穩定在一個較小的電流值。從歐姆定律可知,影響電流強度I的因素有二,電池兩極間的電位差和電池內外電阻的總和R。電池接通,總電阻R并沒有變化,那么電流I的減小只能是電池兩極間的電位差降低的結果。實驗測得的情況也完全證明了這一現象。
如圖4所示,當電路接通后,陰極(銅)的電位變得越來越負;而陽極(鋅)的電位變得越來越正;兩極間的電位差變得越來越小,最后當電流減小并穩定在某值時,陰極的電位負移至Ek,而陽極的電位正移至Ea;兩極的電位差減小到Ek-Ea,由于Ek-Ea《Ek°-Ea° ,所以在R不變的情況下,I移要比I始小很多。
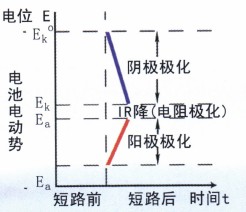
同時,消除或堿弱陽極和陰極極化作用的過程稱為去極化作用或去極化過程。能消除或減弱極化作用的物質稱為去極化劑。因此,可以認為環境中存在的氧化劑就是—種去極化劑。
可見,腐蝕電池的極化作用,導致腐蝕電流減小,從而降低了腐蝕速度。如果沒有極化作用,金屬材料和設備的腐蝕速度也將大得多。極化相當于—種阻力,增大極化有利防腐。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。
-
標簽: 腐蝕金屬極化作用

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414





