0 引言
鎂及鎂合金具有良好的生物相容性、可降解性與力學性能,作為生物可降解骨植入材料得到了廣泛關注[ 1]。但鎂活潑的化學性質限制了其在這一領域的應用。微弧氧化是一種減緩鎂腐蝕的有效方法[ 2]。微弧氧化層的存在使鎂合金在生理環境中的耐蝕性得到明顯的提高。然而,一方面由于作為微弧氧化層的主要成分MgO不能誘導羥基磷灰石形成,導致微弧氧化層具有較低的生物活性[ 3],另一方面,微弧氧化層多孔的結構難以對鎂提供持續的防護[ 4]。
為提升鎂的耐蝕性能與生物性能,并保持體系的可降解性,采用陰極電沉積的方法在微弧氧化的鎂表面構建鈣磷生物涂層。一方面,利用鈣磷涂層促進微弧氧化鎂的生物活性,另一方面, 利用鈣磷涂層對微弧氧化層進行封孔,增加體系的耐蝕性能[5]。鈣磷涂層的成分與人骨組織中的無機成分羥基磷灰石( Hydroxyapatite,HA) 相近,可以誘導HA的再沉積,有助于骨組織的修復和再生[6]。羥基磷灰石盡管生物相容性良好, 但在體液中溶解度很低,不利于降解。除了HA外,其他鈣磷組分被認為是HA在體液中的前驅體。尤其是二水合磷酸氫鈣( Calcium hydrogen phosphate dihydrate, DCPD),在體液中的溶解度很高,其溶解轉化后會促進HA的形成[7]。 Shi等[8] 嘗試在微弧氧化AZ80 鎂合金表面制備DCPD涂層,該涂層體系有效地誘導了HA在鎂合金表面的沉積。盡管在浸泡后表面出現了一些裂紋,但氫氣析出量的測試表明體系腐蝕性能并沒有出現明顯的降低。鈣磷相的轉化過程對促進骨愈合, 保持植入材料的降解具有重要作用[9]。
目前,鎂表面復合涂層體系的報道多集中在涂層的腐蝕性能上[10]。有關鈣磷涂層在微弧氧化層表面的沉積過程及涂層之間協同作用的報道較少。此外,由于制備方法、工藝參數以及電解液選擇存在差別,各研究所報道的涂層的腐蝕性能也不盡相同[11-12]。文中主要研究涂層在模擬體液( SBF) 和細胞培養液中的生物性能。詳細地討論了鈣磷相在微弧氧化層表面的形成過程,以及鈣磷層及微弧氧化層之間的協同作用對體系性能的影響。
1 試驗
1.1 涂層制備
選擇商業用純鎂(純度99.9%)為研究材料, 試樣尺寸為15 mm× 15 mm× 3 mm。采用400~2500 號SiC砂紙對試樣進行打磨,然后用乙醇清洗2 min。利用直流單向脈沖電源對鎂片進行微弧氧化(MAO)處理。鎂片為陽極,不銹鋼板為陰極,電參數為恒電壓模式400 V,頻率100 Hz,占空比10%。電解液組成為20 g Na3PO4 + 1 g KOH。處理時間10 min。之后,對微弧氧化鎂進行陰極電沉積。石墨板為陽極,沉積電解液為0.0835 mol/L Ca(NO3)2 +0.05 mol/L KH2PO4 的混合溶液,溶液pH值調整至4.6。在初始電流密度為4.2 mA/cm 2,溫度為47℃,沉積電壓為3.5 V的條件下沉積60 min。
1.2 結構表征及電化學性能測試
采用XRD、SEM、EDS和激光共聚焦顯微鏡(CLSM)對涂層組織結構和形貌進行觀察分析。采用Gamry R3000 電化學工作站對涂層的電化學性能進行評價(包括動電位極化曲線和電化學阻抗譜測試)。測試介質為模擬體液( SBF),成分見參考文獻[13],測試溫度為(37±0.5)℃。測試前將試樣浸泡在SBF中30 min,使試樣表面狀態達到穩定。動電位極化曲線的測試從開路電位以下0.2 V開始,終止電流密度為2 mA/cm 2,掃描速率為0.5 mV/s。采用Corrview軟件對測得的極化曲線進行擬合。電化學阻抗譜(EIS)測量頻率范圍為10 5~10-2 Hz。輸入信號為開路電位上下擾動10 mV。采用Zsimpwin軟件對阻抗譜進行擬合。
1.3 生物性能測試
對涂層生物性能的評價包括骨形成能力和細胞黏附能力。骨形成能力試驗時,將涂層分別浸泡到SBF和組織液中,觀察涂層的組織結構變化及HA沉積狀況。細胞黏附試驗時,將涂層浸泡到細胞培養液中,在涂層表面植入50 000 個髖關節組織細胞,細胞中添加染色劑,采用光學顯微鏡觀察細胞的增殖狀況。
2 結果與討論
2.1 涂層結構特征
涂層的物相組成如圖1 所示。微弧氧化層的相組成是Mg3(PO4)2 和MgO。鈣磷涂覆后,涂層的主要成份是二水合磷酸氫鈣(DCPD)。
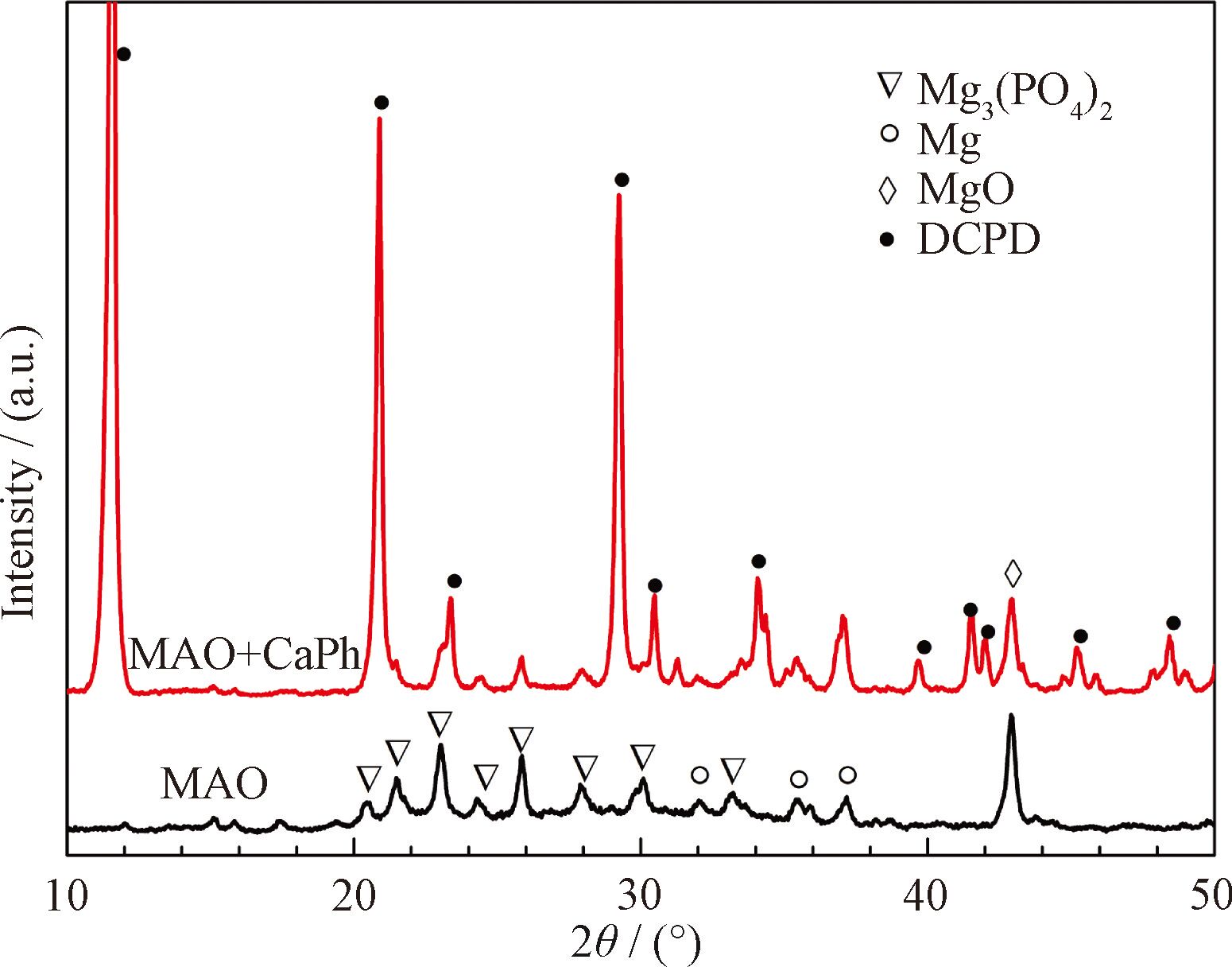
圖1 鈣磷涂覆前后微弧氧化鎂的XRD圖譜
涂層的表面和截面形貌如圖2 所示。微弧氧化層表面呈現出多孔結構,微孔不均勻地分布在試樣表面(圖2(a))。在表面可以觀察到少量的裂紋,這是由于在陶瓷層成膜過程中電解液的冷卻作用導致的[14]。
微弧氧化層的截面形貌(圖2(c))呈現明顯的雙層結構,約為1~2 μm的內部致密層均勻地形成在鎂基體表面,外部多孔層存在著大量的微孔和放電通道(Discharge channels),其厚度約為25 μm。
鈣磷涂層形貌為片狀結構(圖2( b)),其尺寸大約在幾十微米,呈現出典型的DCPD形貌特征[15]。
涂層的橫截面顯示鈣磷層的厚度約為15 μm( 圖2( d)),其中,微弧氧化外層的微孔幾乎完全被鈣磷相填充,鈣磷層和微弧氧化層交錯結合在一起,表現出良好的界面結合狀況。
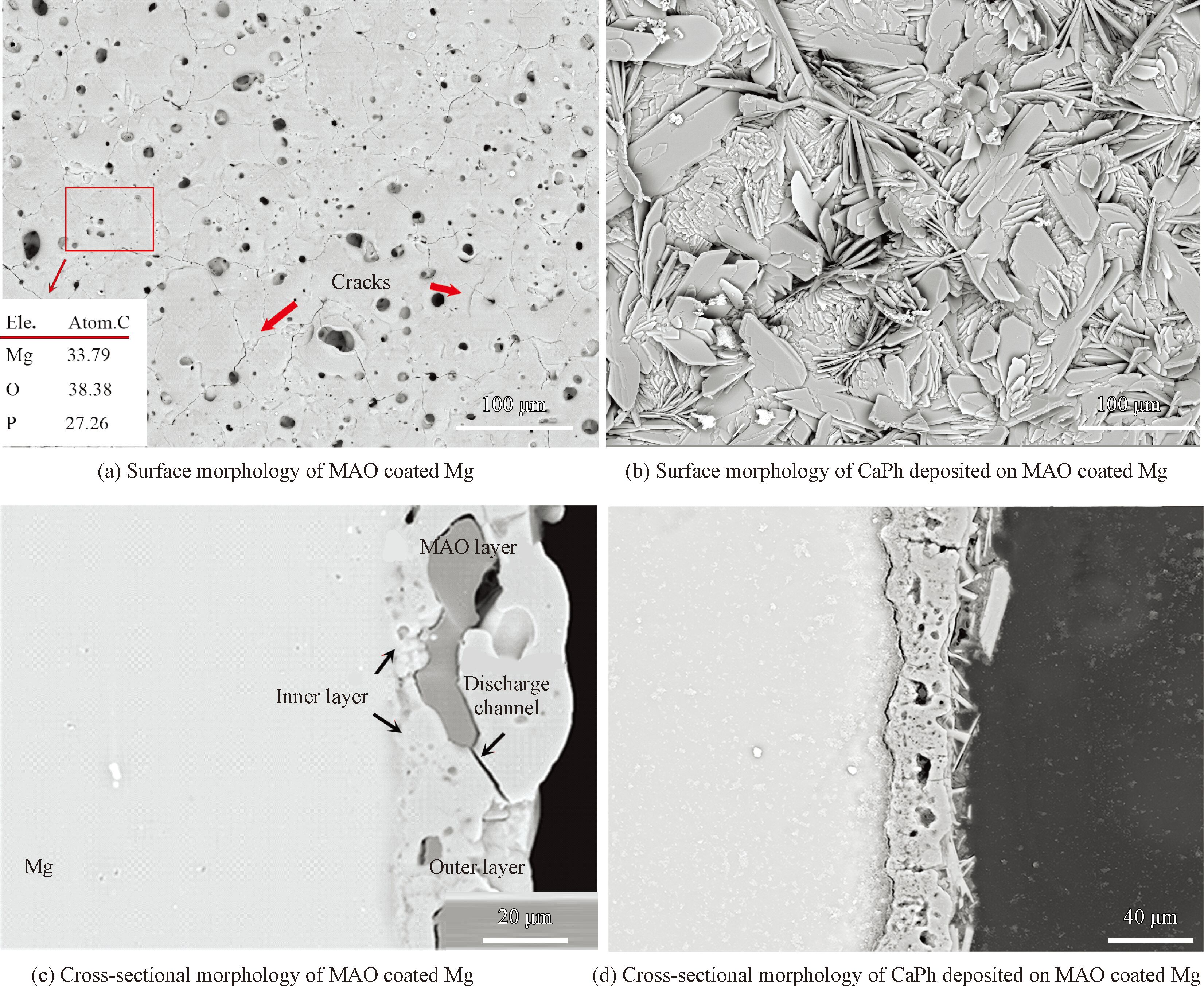
圖2 鈣磷涂覆前后微弧氧化鎂的表面和截面形貌
2.2 DCPD在微弧氧化層上的沉積機制
由于涂層中不存在HA或磷酸八鈣(Octacalcium phosphate, OCP) 等含有PO 3- 4 基團的化合物,沉積過程中電解液中的H2PO- 4 只需一步水解,即可與Ca2+相結合生成DCPD,形成過程并不復雜,如反應式(1)~(3)所示:
為了便于討論DCPD在微弧氧化鎂表面的形核規律,觀察了不同沉積時間(5 和30 s) 下DCPD的形核位置及分布規律,如圖3 所示。同時,采用EDS掃描Ca元素的分布圖(Elemental mapping)。值得注意的是, 在電場的作用下,DCPD在微弧氧化層表面的形核長大并不是隨機發生的。沉積開始時,形核的位置主要集中在微弧氧化層表面的微孔處(圖3( a)),對應的鈣元素分布圖中可見微孔附近Ca的分布較多(圖3( c))。隨沉積時間的增加,微弧氧化層表面的Ca分布越來越多(圖3(d)),意味著DCPD不斷聚集長大(圖3(b))。由于微弧氧化層的結構特點,其微孔結構可分為通孔和半封閉孔,此外,高壓下形成的微弧氧化層中還存在大量的放電通道(圖2(c))。這些通孔和放電通道為電沉積過程提供了離子交換通道。沉積開始時, DCPD在電場力作用下優先在通孔位置沉積。與此同時,微弧氧化層的MgO在弱酸性的電解液中會發生部分溶解,其反應如方程式(4)所示:
(4)
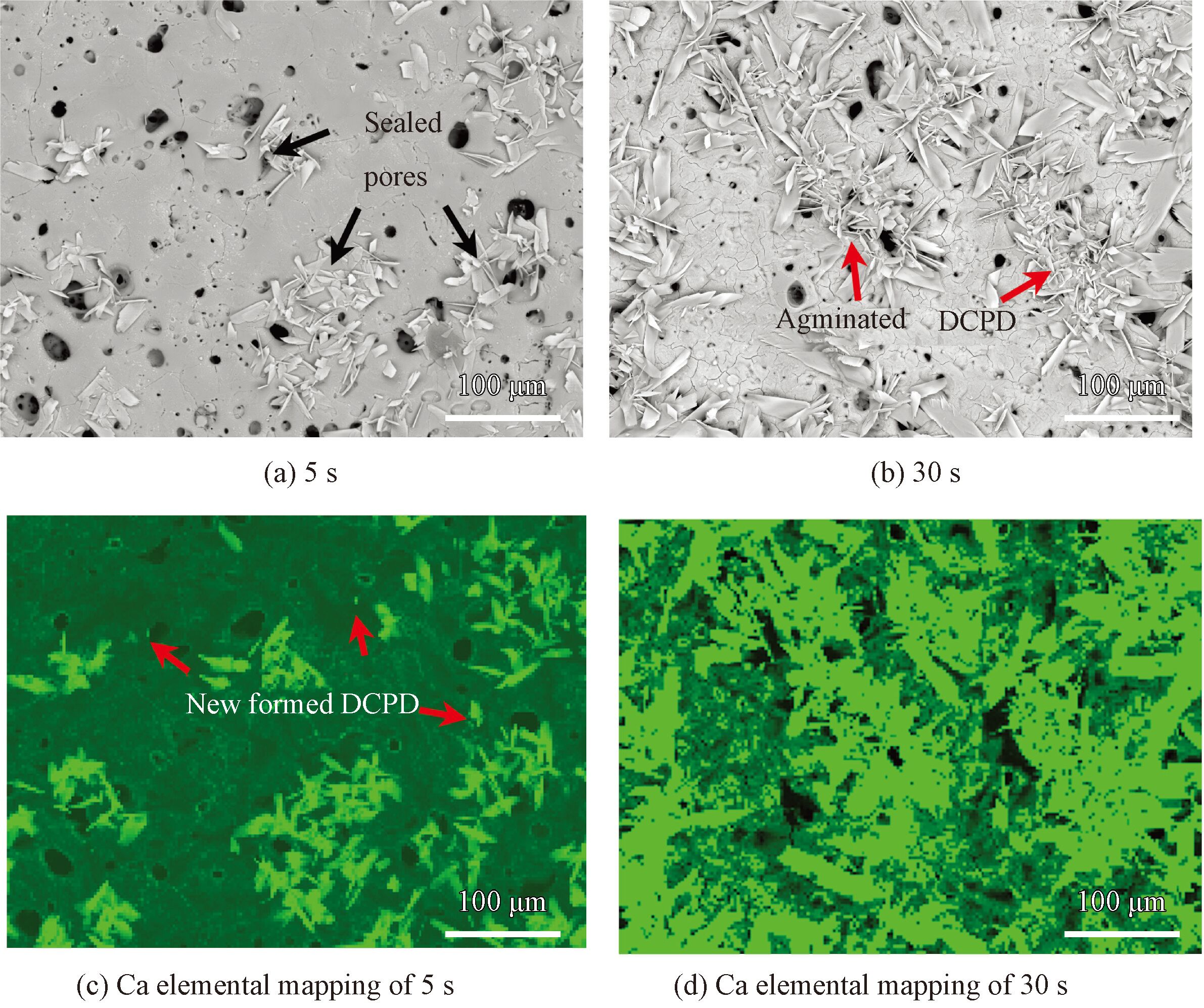
圖3 沉積不同時間下DCPD的SEM形貌與對應的元素分布圖
微弧氧化層的溶解使涂層中的半封閉孔暴露在電解液中,成為通孔。這為離子的交換提供了更多的通道,使DCPD持續沉積并覆蓋整個表面。最終在微弧氧化層表面形成一層均勻的DCPD。
2.3 涂層的電化學腐蝕行為
鈣磷涂覆前后微弧氧化鎂的電化學阻抗譜及相應的等效電路如圖4( a)~4( d) 所示[16]。 Bode圖表明,微弧氧化試樣在0~48 h內呈現出3 個時間常數(圖4(a)),分別分布在高頻(10 3~10 4 Hz)、中頻(1~10 2 Hz)和低頻(10-2~1 Hz)區域。 3 個時間常數分別涉及微弧氧化外層、內層和基體與涂層之間的雙電層在體系中的電化學響應。鈣磷涂覆后,阻抗譜圖仍呈現出3 個時間常數(圖4( c)),但其所代表的物理意義發生了變化。高頻的時間常數代表鈣磷層和微弧氧化外層相結合的電化學響應,中頻和低頻分別代表微弧氧化內層和雙電層的電化學響應。
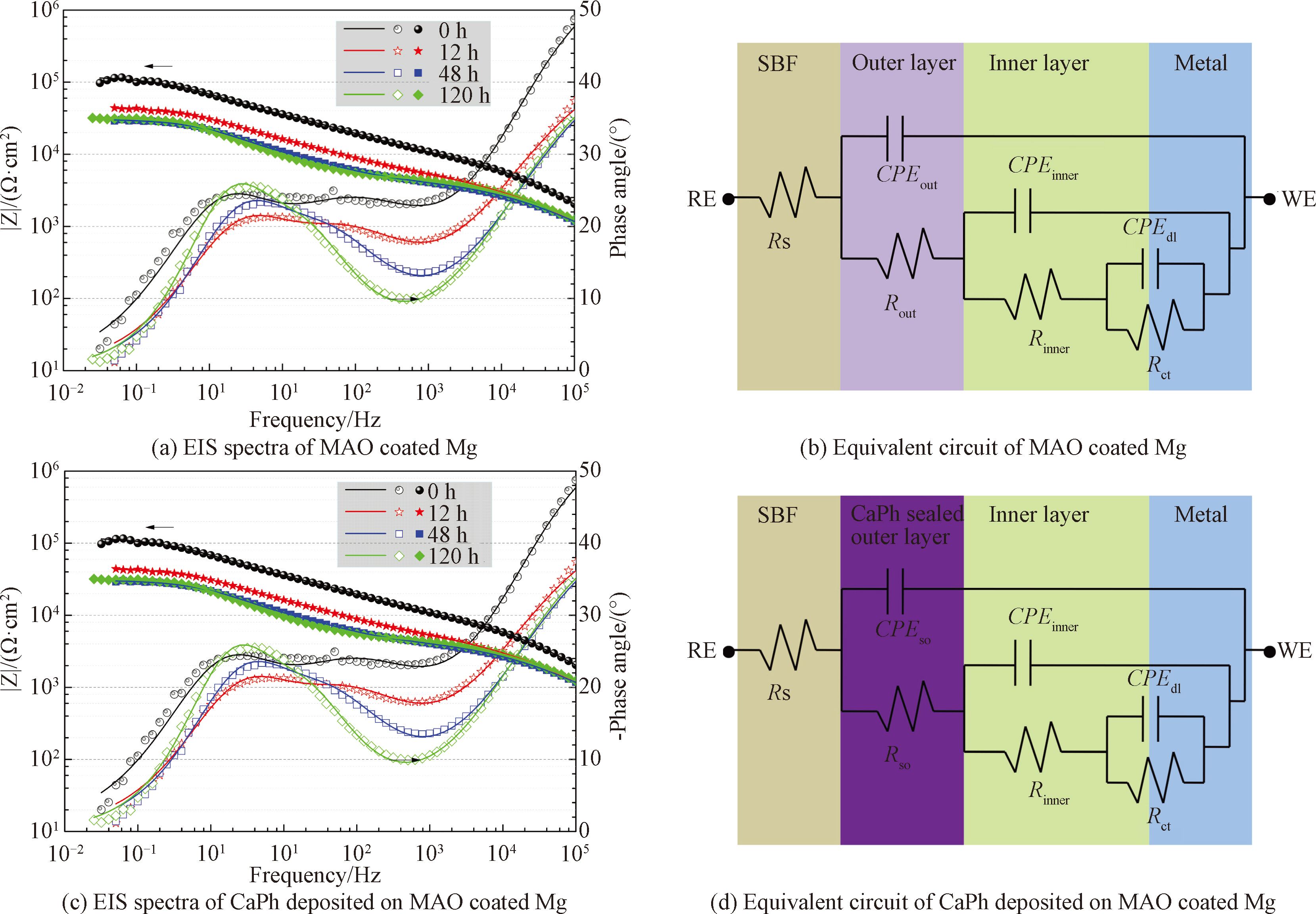
圖4 復合涂層在SBF中的電化學阻抗譜和相應的等效電路[16]
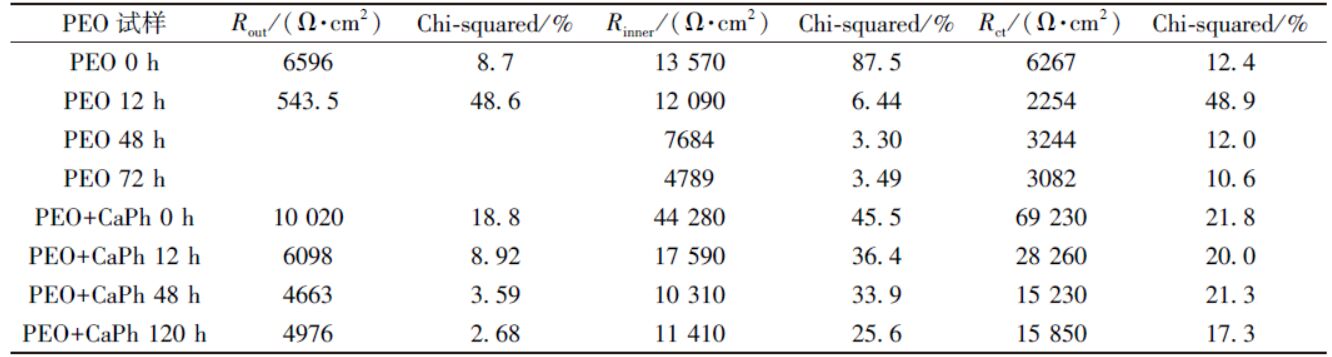
在圖4(b)和4( d)的等效電路中,R 與 CPE 分別代表各自元件對應的極化電阻值與常相位元件值。其中,Rs 為溶液電阻,Rout、 CPEout、Rinner 與 CPEinner 分別表示微弧氧化外層和內層的極化電阻值與電容值。 Rso 與 CPEso 分別表示鈣磷涂覆后微弧氧化外層的極化電阻值與電容值。 Rct 與 CPEdl 分別表示鎂基體和微弧氧化層之間的電荷轉移電阻和雙電層電容。
低頻的阻抗模值可以反應體系的耐蝕性能。通常鎂及鎂合金的阻抗模值僅為10 3 Ω·cm 2 左右,在SBF浸泡過程中阻抗模值通常迅速降低[17]。微弧氧化試樣浸泡初期(0 h)低頻阻抗模值為3×10 4 Ω·cm 2。在6 h內下降到10 4 Ω·cm 2左右,但在隨后的浸泡過程中基本保持穩定。對于大多數的生物植入材料而言,在植入初期耐蝕性能下降最為明顯。此后,腐蝕產物和HA的沉積會阻止腐蝕介質與基體的接觸,阻抗模值會在一定的時間范圍內保持不變。鈣磷涂覆后,試樣的低頻阻抗模值達到了10 5 Ω·cm 2,表明體系的耐蝕性能得到進一步提升。阻抗模值在0~12 h內下降到4×10 4 Ω·cm 2,之后幾乎保持不變,表現出了穩定的耐蝕性能。擬合后各元件的總電阻值(鈣磷層、微弧氧化層和雙電層擬合后電阻值的總和)如圖5 所示,其變化趨勢與低頻阻抗模值變化趨勢相同,在浸泡初期總電阻值快速下降, 而后基本保持不變,進一步說明了復合涂層在SBF中耐蝕性能較為穩定。擬合后各元件極化電阻值及相應誤差如表1 所示。各元件所對應阻抗均呈現出緩慢下降的趨勢,擬合誤差較低, 說明采用的等效電路與試樣的阻抗譜圖匹配良好。
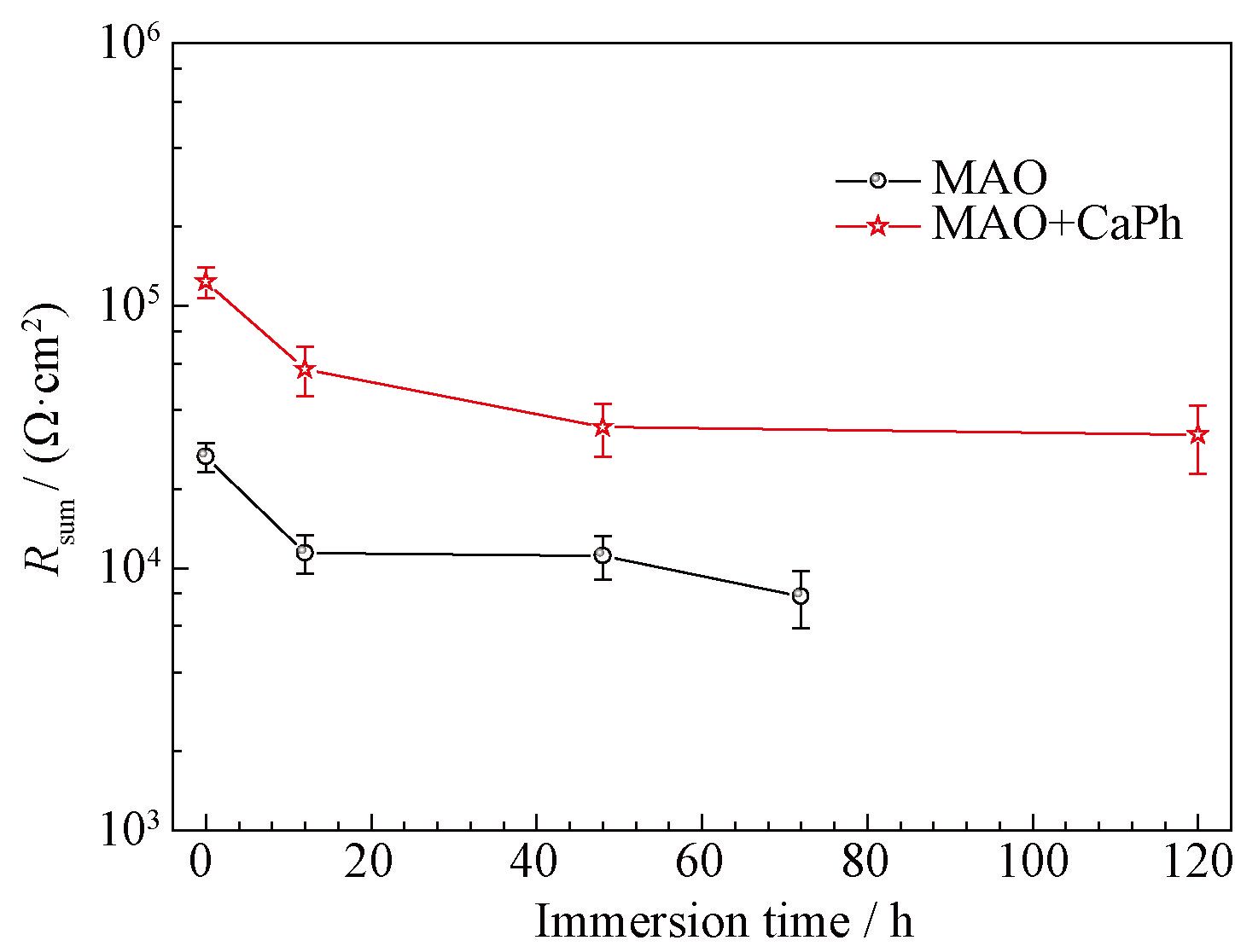
圖5 鈣磷涂覆前后微弧氧化鎂的總極化電阻值
表1 電化學阻抗譜圖的擬合結果
鈣磷涂覆前后的動電位極化曲線如圖6 所示。純鎂的腐蝕電流密度( i corr) 和腐蝕電位(Ecorr)僅為(1.74±0.52) × 10-4 A·cm-2和-1.92 V。經微弧氧化處理后,i corr 下降了約2 個數量級, Ecorr 上升了200 mV。鈣磷涂覆試樣的 i corr 略有下降,Ecorr 則繼續上升了約200 mV。該試樣在SBF中浸泡120 h后,Ecorr 降低了60 mV,但 i corr沒有明顯變化。說明在120 h浸泡過程中,腐蝕速率并沒有顯著增加。 EIS和極化曲線結果表明復合涂層大幅度提升了鎂基體的耐蝕性能。
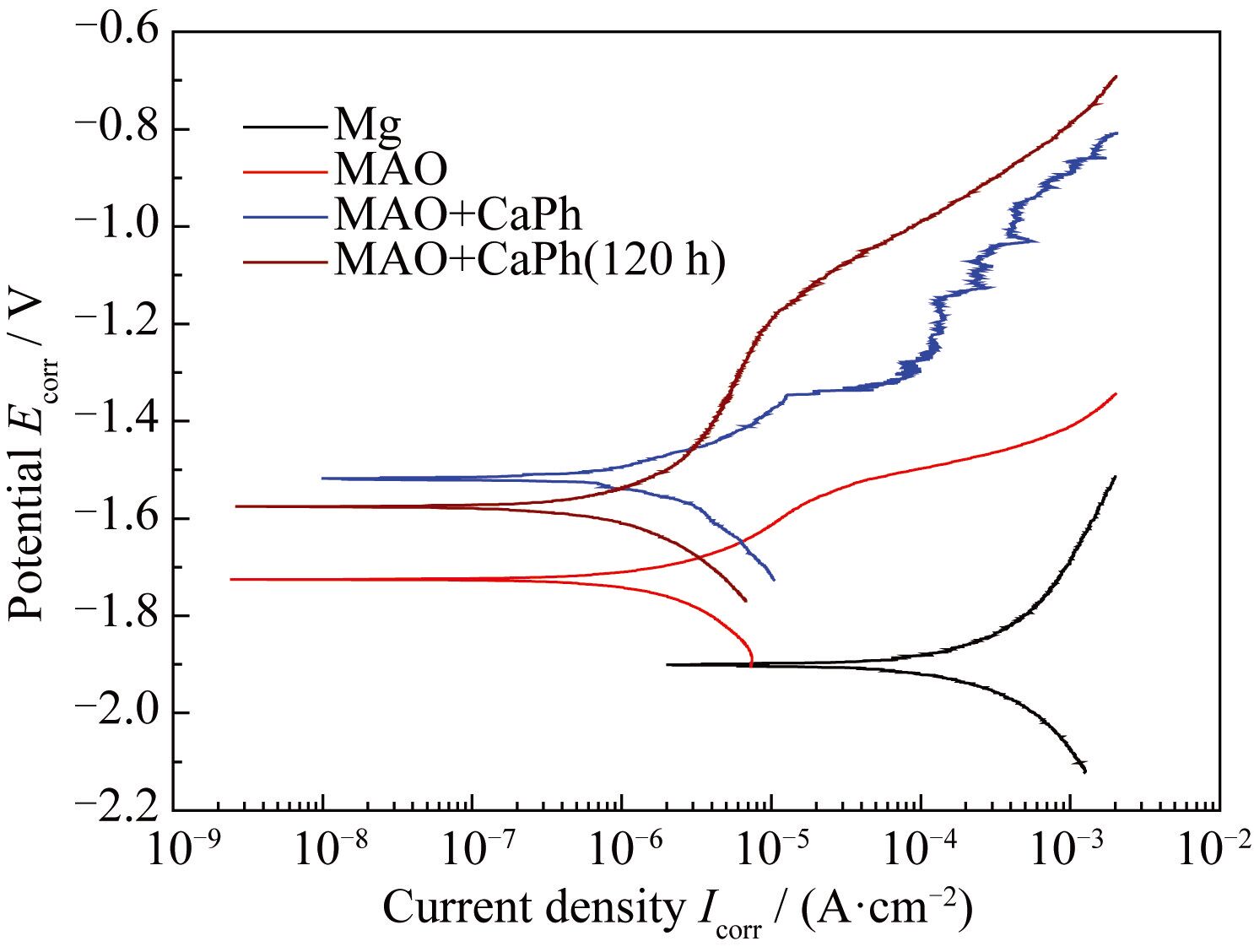
圖6 涂覆前后鎂在SBF中的動電位極化曲線
2.4 涂層的生物性能
為了評價涂層的骨形成能力,鈣磷涂覆的微弧氧化鎂被分別浸泡在SBF和細胞培養液中。在SBF中浸泡120 h后涂層的表面形貌和物相組成分別如圖7(a)和7(b)所示。浸泡后DCPD片的尺寸明顯減小,XRD結果表明,DCPD衍射峰的相對強度明顯降低,與此同時,發現了新的HA衍射峰。這表明隨著DCPD的溶解,HA逐漸沉積到試樣表面。
在細胞培養液中浸泡14 d后的表面形貌如圖8(a)和8(b)所示。圖中仍可以清晰地觀察到DCPD的片狀結構,且其尺寸沒有明顯的變化。在高的放大倍數下(圖8(b))可以觀察到球狀和菜花狀結構。 EDS分析結果表明,該結構中所含有的鈣磷元素原子百分比約為1.6。同樣比例的鈣磷結構在其他研究中也有報道,其為典型的類骨羥基磷灰石組織結構[18]。
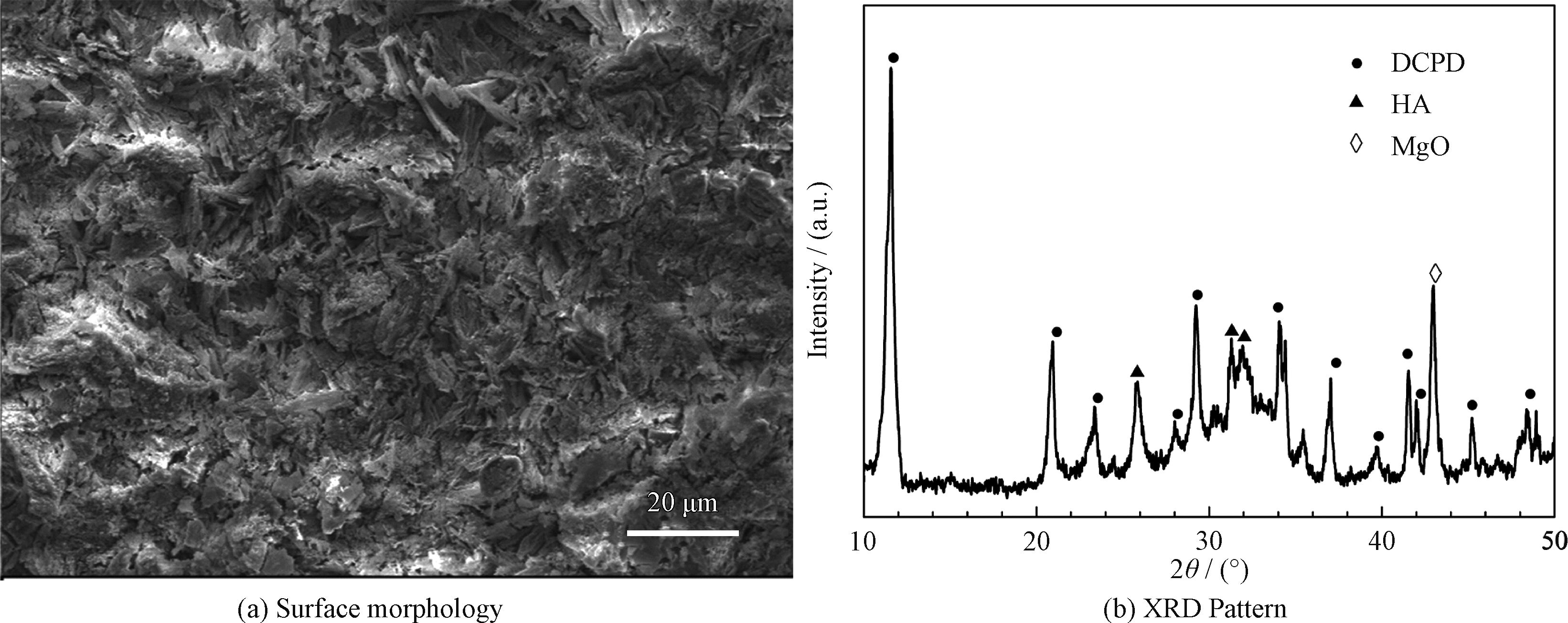
圖7 復合涂層在SBF中浸泡120 h后的表面形貌和XRD圖譜

圖8 復合涂層在細胞培養液中浸泡14 d后的表面形貌
浸泡試驗結果表明,無論是在SBF還是細胞培養液中,涂層均表現出了誘導HA沉積的能力。 DCPD在弱堿性體液中的溶解度較高,溶解后依據反應式(5)及(6)在涂層表面附近釋放出一定量的Ca2+和PO 3- 4。試樣表面局部鈣磷離子濃度的升高,會促進HA的沉積,如反應式( 7) 所示:
有所不同的是,通過比較DCPD在兩種介質中的結構演化發現,DCPD在SBF中的溶解速率更快,從而更易于誘導HA沉積在試樣表面。由于SBF的化學成分與細胞培養液中的無機成分相似,其主要用于評估HA的體外沉積能力,與體液中蛋白物質的氧化還原和細胞間反應無關。同時,SBF溶液每2 d更換一次,及時地補充了試樣表面由于HA沉積所消耗的Ca和P原子,從而加速了HA的沉積過程。因此, 在SBF中DCPD的溶解和HA的轉化速率更快。
在細胞培養液中培養14 d后的細胞黏附情況如圖9 所示。大量的活細胞黏附在了涂層表面,且細胞形狀狹長,表明細胞在培養后出現了的增殖分化,表現出了良好的細胞黏附和增殖分化能力。研究報道,與鎂的氧化物或無機鹽相比,細胞的絲狀偽足更優先于在鈣磷相上沉積[19]。從圖9 中可以觀察到,黏附的細胞呈帶狀或者網狀分布,其特征與DCPD的結構相似,可以推斷,細胞更優先地在鈣磷物相上粘附。此外,細胞的黏附還與涂層的表面狀態和腐蝕性能有關[20]。在整個培養過程中,DCPD不斷地溶解并轉化成HA,在一定程度上降低了細胞在涂層上的黏附數量。但由于體系的耐蝕性較高, DCPD向HA轉化進行緩慢,保持了表面狀態的穩定性,因而對細胞在表面粘附影響有限。
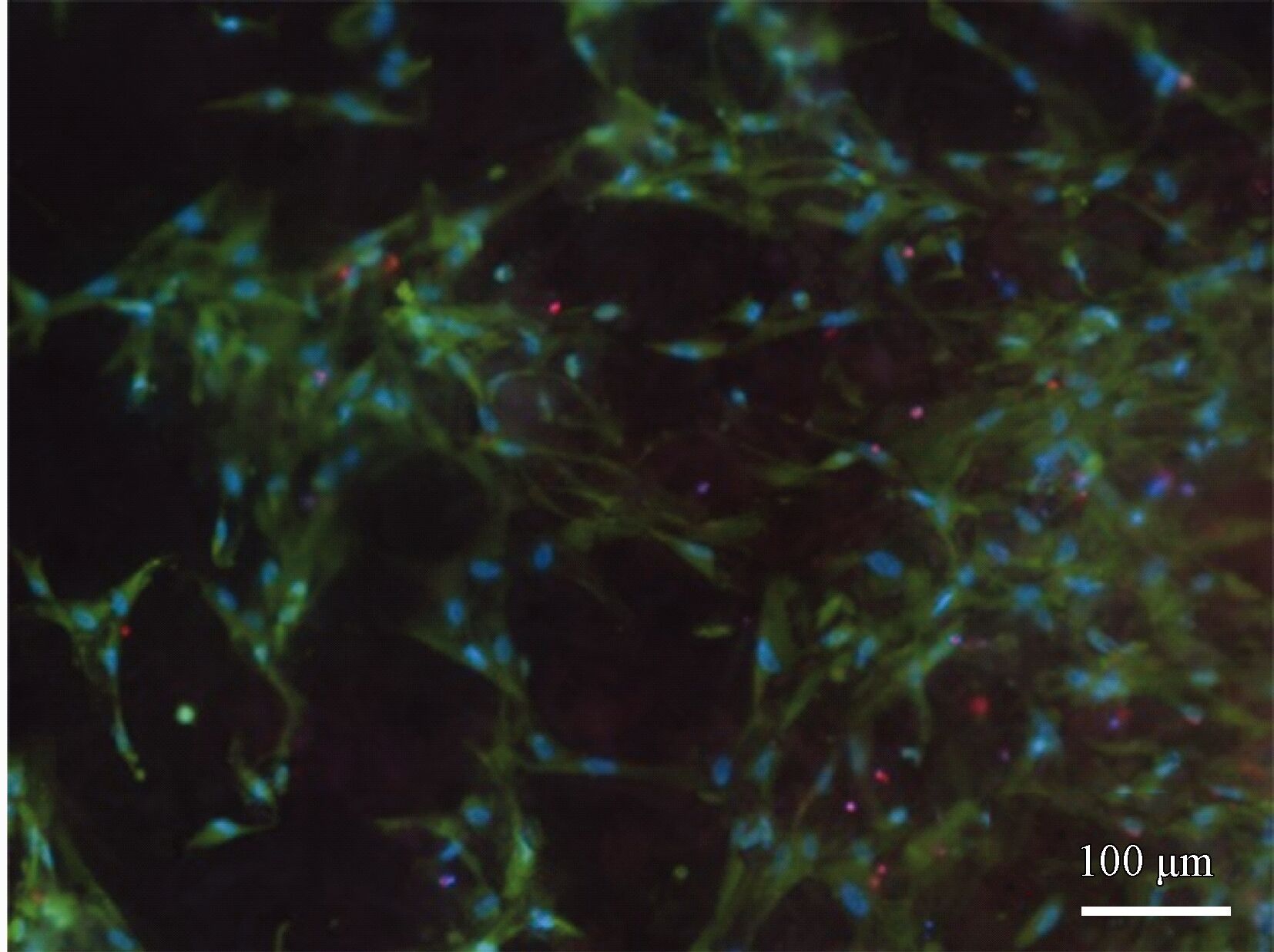
圖9 復合涂層在細胞培養液中浸泡14 d后的細胞粘附
2.5 復合涂層的耐蝕性及生物活性
作為骨植入材料,鈣磷涂層具有明顯的優勢。 DCPD被認為是HA在體液中的前驅體,擁有較高的Gibbs自由能,在模擬體液中浸泡后可以溶解釋放出Ca2+ 和PO 3- 4,誘導HA形成[21]。這一過程對于促進骨愈合、誘導骨生長具有顯著的作用。因此,研究者們更愿意嘗試在鎂表面構建DCPD涂層,而不是直接沉積HA涂層[22]。但直接在鎂表面沉積DCPD并不是最佳選擇,由于涂層與鎂基體靠物理吸附,兩者之間的結合力較差,DCPD在體液中的快速溶解伴隨部分脫落會導致鎂基體裸露在腐蝕介質中,從而造成基體的快速腐蝕失效。
采用微弧氧化與電沉積相結合的復合涂層可以有效地解決這一問題。微弧氧化層的存在,不僅阻礙了腐蝕介質的滲透,提高了鎂的耐蝕性,而且其粗糙的表面為鈣磷相的形核提供了更多的位置。此外,微弧氧化層和鈣磷層之間通過機械交錯咬合(圖2( d)),可有效提高涂層與基體的結合力,從而降低DCPD在SBF和細胞培養液中的溶解速率,使整個涂層體系可以穩定降解。在浸泡初期,由于DCPD層的封孔作用,延緩了腐蝕介質的快速滲透,提高了涂層體系的耐蝕性。隨著浸泡時間的延長,盡管DCPD的溶解會加速涂層體系的腐蝕,但由于促進了HA的沉積,在一定程度上保持了體系的穩定性。
毫無疑問,體系的耐蝕性能對其骨形成和細胞黏附過程起到至關重要的影響。以往有關DCPD涂層細胞黏附報道較少的主要原因是涂層體系的腐蝕性能較差,腐蝕反應阻礙了HA的沉積和細胞絲狀偽足的吸附[23]。通過構建微弧氧化和鈣磷復合涂層,強化了涂層與基體之間的界面結合,提升了體系的穩定性。保證了DCPD向HA轉化和細胞絲狀偽足的黏附過程的平穩進行。在細胞培養液中浸泡14 d后,仍可觀察到DCPD的存在,同時觀察到類骨狀HA結構(圖8(b)),活細胞幾乎分布在整個復合涂層試樣的表面(圖9), 表現出了良好的骨形成和細胞黏附能力。
3 結論
采用微弧氧化和電沉積相結合的方法,在鎂表面制備了微弧氧化層及鈣磷復合涂層,通過復合涂層組織及性能研究,得到的主要結論如下。
(1) 微弧氧化層的相組成為Mg3( PO4)2 和MgO,鈣磷涂層的主要相結構為DCPD;鈣磷相優先在微弧氧化層中的通孔和放電通道處形核,鈣磷相的沉積對微弧氧化層起到封孔作用,鈣磷層和微弧氧化層之間通過機械咬合方式結合在一起。
(2) 復合涂層表現出較高的耐蝕性能和生物活性,與未涂覆的鎂基體相比,腐蝕電位上升了400 mV,腐蝕電流密度降低了約3 個數量級, 在SBF中浸泡120 h后的阻抗測量過程中,體系總極化電阻值穩定在4×10 4 Ω·cm 2。
(3) 在SBF及細胞營養液的浸泡過程中, DCPD逐漸溶解并促進類骨狀HA在涂層表面析出,涂層表現出良好的細胞活性,活細胞幾乎粘附在整個涂層表面。
參考文獻
[1] STAIGER M P,PIETAK A M,HUADMAI J,et al.Magne-sium and its alloys as orthopedic biomaterials:A review[J].Biomaterials,2006,27:1728-1734.
[2] YANG J J,LU X P,BLAWERT C,et al.Microstructure and corrosion behavior of Ca/P coatings prepared on magnesi-um by plasma electrolytic oxidation[J].Surface & Coatings Technology,2017,319:359-369.
[3] KHALAJABADI S Z,KADIR M R A,IZMAN S,et al.The effect of MgO on the biodegradation,physical properties and biocompatibility of a Mg/HA/MgO nanocomposite manufac-tured by powder metallurgy method [J].Journal of Alloys and Compounds,2016,655:266-280.
[4] GAO J H,GUAN S K,CHEN J,et al.Fabrication and characterization of rod-like nano-hydroxyapatite on MAO coat-ing supported on Mg-Zn-Ca alloy[J].Applied Surface Sci-ence,2011,257:2231-2237.
[5] TIAN P,LIU X,DING C.In vitro degradation behavior and cytocompatibility of biodegradable AZ31 alloy with PEO/HT composite coating[J].Colloids and Surfaces B-Biointerfac-es,2015,128:44-54.
[6] SONG Y W,ZHANG S,LI J,et al.Electrodeposition of Ca-P coatings on biodegradable Mg alloy:In vitro biomineralization behavior[J].Acta Biomaterialia,2010,(6):1736-1742.
[7] BAKHSHESHI-RAD H R,IDRIS M H,KADIR M R,Syn-thesis and in vitro degradation evaluation of the nano-HA/MgF2 and DCPD/MgF2 composite coating on biodegradable Mg-Ca-Zn alloy[J].Surface & Coatings Technology,2013,222:79-89.
[8] SHI Y,QI M,CHEN Y,et al.MAO-DCPD composite coat-ing on Mg alloy for degradable implant applications[J].Ma-terials Letters,2011,65:2201-2204.
[9] SHADANBAZ S,DIAS G J.Calcium phosphate coatings on magnesium alloys for biomedical applications:A review[J].Acta Biomaterialia,2012,8:20-30.
[10] GAO Y H,YEROKHIN A,MATTHEWS A.Deposition and evaluation of duplex hydroxyapatite and plasma electrolytic oxidation coatings on magnesium [J].Surface & Coatings Technology,2015,269:170-182.
[11] SHI H,YE X,HE F,et al.Improving osteogenesis of calci-um phosphate bone cement by incorporating with lysine:An in vitro study [J].Colloids and Surfaces B-Biointerfaces,2019,177:462-469.
[12] ANAWATI,ASOH H,ONO S.Enhanced uniformity of apa-tite coating on a PEO film formed on AZ31 Mg alloy by an al-kali pretreatment [J].Surface & Coatings Technology,2015,272:182-189.
[13] BAKHSHESHI H R,HANZAH E,ISMAIL A F,et al.In vitro degradation behavior,antibacterial activity and cytotox-icity of TiO2-MAO/ZnHA composite coating on Mg alloy for orthopedic implants [J].Surface & Coatings Technology,2018,334:450-460.
[14] LU X P,BLAWERT C,HUANG Y D,et al.Plasma elec-trolytic oxidation coatings on Mg alloy with addition of SiO2 particles[J].Electrochimica Acta,2016,187:20-33.
[15] CHENG Z,LIAN J,YANG H,et al.Biocompatible DCPD coating formed on AZ91D magnesium alloy by chemical depo-sition and its corrosion behaviors in SBF [J].Journal of Bionic Engineering,2014,11:610-619.
[16] HAN J P,BLAWERT C,TANG S W,et al.Effect of sur-face pre-treatments on the formation and degradation behavior of a caluium phosphate coationg on pure magnesium [J].Coatings,2019,259:1-18.
[17] MAO L,ZHOU H,CHEN L,et al.Enhanced biocompati-bility and long-term durability in vivo of Mg-Nd-Zn-Zr alloy for vascular stent application[J].Journal of Alloys and Com-pounds,2017,720:245-253.
[18] SUNDAR L S,ANJUM N A,FERRO M C,et al.Biocom-patibility and biotoxicity of in-situ synthesized carboxylated nanodiamond-cobalt oxide nanocomposite[J].Journal of Ma-terials Science & Technology,2017,33:879-888.
[19] KHALAJABADI S Z,KADIR M R A,IZMAN S,et al.The effect of MgO on the biodegradation,physical properties and biocompatibility of a Mg/HA/MgO nanocomposite manufac-tured by powder metallurgy method [J].Journal of Alloys and Compounds,2016,655:266-280.
[20] ASRI R I M,HARUN W S W,SAMYKANO M,et al.Cor-rosion and surface modification on biocompatible metals:A review[J].Materials Science & Engineering C,Materials for Biological Applications,2017,77:1261-1274.
[21] HAN J P,TANG S W,SAN H S,et al.Formation mecha-nism of calcium phosphate coating on a plasma electrolytic oxidized magnesium and its corrosion behavior in simulated body fluids[J].Journal of Alloys and Compounds,2020,818:152834.
[22] ZENG C Y,ZENG R C,LI C L,et al.Comparison of calci-um phosphate coatings on Mg-Al and Mg-Ca alloys and their corrosion behavior in Hank′s solution[J].Surface & Coat-ings Technology,2010,204:3636-3640.
[23] SURMENEV R A,SURMENEVA M A,IVANOVA A A,Significance of calcium phosphate coatings for the enhance-ment of new bone osteogenesis-A review[J].Acta Biomate-rialia,2014,10:557-579.
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《中國腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網官方QQ群:140808414





