CO2大點源包括大型化石燃料或生物能源設施、主要CO2排放型工業、天然氣生產、合成燃料工廠以及基于化石燃料的制氫工廠[1,2]。隨著工業化進程的不斷推進,CO2的捕集與封存開始受到重視。目前,工業最常用單乙醇胺 (MEA) 捕集CO2[3,4,5,6]。為了節約成本,常用碳鋼作為吸收裝置和汽提裝置材料,但碳鋼易被腐蝕,因此捕集過程中的腐蝕問題日益凸顯。本文總結了國外近年來對MEA-CO2腐蝕體系腐蝕機理及緩蝕劑的主要研究成果,為解決CO2捕集過程中的腐蝕問題,保證裝置安全高效運行研究提供參考。
1 腐蝕機理
單乙醇胺 (MEA) 溶液在吸收CO2過程中的化學反應式如式 (1),RNH2、RNHCOO-、RNH3+分別代表胺、氨基甲酸根離子。氨基甲酸根離子與質子化胺水解產生的H3O+和HCO3-是導致溶液具有腐蝕性的主要原因[7]。
![]()
Soosaiprakasam等[8]在研究MEA吸收CO2溶液腐蝕行為時較全面地提出MEA-CO2溶液對碳鋼的腐蝕機理,碳鋼在該腐蝕體系中發生了電化學腐蝕。在無氧的條件下陰極反應主要是自由水、水合氫離子、HCO3-的還原反應[9],如式 (2)~(4),在有氧條件下陰極反應除了式 (2)~(4),還增加了氧氣的還原反應,見式 (5)。

其中,反應式 (3) 中水合氫離子有4個來源,如式 (6)~(9)。
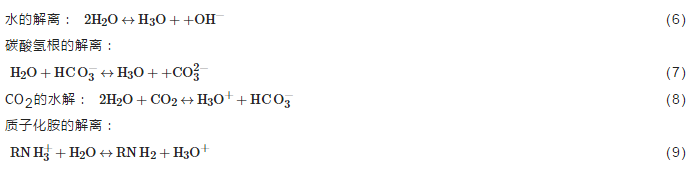
反應式 (4)、(7) 中HCO3-有兩個來源,一是CO2的水解如式 (8),二是氨基甲酸根的水解,如式 (10)。
氨基甲酸根水解:

2 影響因素
2.1 氧
溶液中有氧時,MEA-CO2-O2腐蝕體系中陰極反應一部分為氧氣得電子生成OH-,在該體系下氧氣溶于溶液中對鋼材的腐蝕有一定的影響。
Veawab等[10]研究了在80 ℃和30 ℃下MEA-CO2-O2體系中氧氣濃度對1020碳鋼腐蝕行為的影響,研究發現,進氣氧含量從0%升高到10%,80 ℃溶液中碳鋼腐蝕速率增加,由0.82 mm/a增加到1.16 mm/a。但在30 ℃溶液中碳鋼的腐蝕速率先降低后升高,當進氣氧含量為3%時,碳鋼的腐蝕速率降至0 mm/a,當氧氣濃度升高至10%時,碳鋼的腐蝕速率上升至0.0254 mm/a,Veawab等認為,出現這種現象的原因是氧氣的增加使碳鋼表面生成了鈍化膜,因此降低了腐蝕速率。
Kladkaew等[7]在通過極化曲線研究氧氣濃度對1020碳鋼腐蝕行為影響時也證實了上述結論,實驗進氣氧氣含量為0%、6%、21%和100%,溶液溫度為80 ℃,鈍化電流密度由小至大排序為21%<6%<100%<0%,表明溶液中一定濃度的溶解氧有助于金屬表面形成更加穩定的氧化膜,但過多的氧反而會降低鈍化膜的穩定性。除此之外,其實驗得到的不同氧氣濃度極化曲線中電流密度相差不大,表明氧氣濃度的變化對腐蝕的影響不大。
Soosaiprakasam等[8]在研究MEA-CO2-O2腐蝕行為時觀察到隨著氧氣的增加,極化曲線塔菲爾區的陰極曲線斜率數值變大,陽極曲線斜率并未發生變化,說明氧氣的增加帶來了新的陰極反應,但對陽極反應速率并未有太大影響,即金屬的腐蝕速率并未顯著升高。由此,推測氧氣在水中溶解度有限,氧氣濃度的提升并不能使溶液的氧化性質有明顯提升從而增加腐蝕速率。
2.2 MEA濃度
MEA濃度是影響MEA-CO2溶液腐蝕性的重要因素。隨著MEA濃度升高,腐蝕速率不斷升高。MEA濃度升高意味著溶液中吸收CO2的能力升高,導致溶液中RNHCOO-、RNH3+、HCO3-數量增多,從而引起腐蝕速率增加[10]。Soosaiprakasam等[8]在研究MEA濃度對溶液腐蝕影響時觀察到不同MEA濃度下的Tafel陰陽極曲線斜率的變化,這說明了當MEA濃度發生改變,陰陽極的腐蝕反應也發生了一定的變化。Kladkaew等[7]在實驗中觀察到不同MEA濃度下極化曲線鈍化區的電流密度也不相同,隨著MEA濃度升高,鈍化電流密度升高,表明了MEA濃度升高使鈍化膜的保護性能降低。
2.3 溫度
從反應動力學方面考慮,溫度是影響化學反應一個重要因素。溫度的改變導致各反應平衡變化,包括CO2的吸收,氨基甲酸根的形成,氨基甲酸根的水解,溶液的pH值和化學物質的溶解度[11]。一般來說,隨著溶液溫度升高,腐蝕速率升高。丹麥火力發電廠的燃燒后CO2捕集工業試驗裝置和加拿大某廠的天然氣燃燒后捕集CO2工業試驗裝置中溫度較高的部位 (100~120 ℃),如汽提塔頂部、汽提塔底部、汽提塔進出口管線等,腐蝕速率較高[12]。隨著溫度升高,反應式 (1) 會增強,因此溶液中存在的較大量的H+、HCO3-以及H3O+。檢測到溶液pH值在降低,從而使金屬溶解和氧化劑還原之間的平衡受到干擾,為保持平衡,更多的Fe將溶解到溶液中,隨后產生更多的電子用于氧化劑的還原。從而加速腐蝕速率[7,10],Soosaiprakasam等[8]研究溫度對MEA-CO2腐蝕體系影響時,發現在40 ℃時鈍化區電流密度比80 ℃時低,但40 ℃時的電流密度波動較大。表明了40 ℃時鈍化膜雖抗腐蝕效果好,但40 ℃時形成的鈍化膜穩定性沒有80 ℃高。結合Pourbaix圖提出觀點,認為出現這種現象的原因是:Fe(OH)4-的存在導致氧化膜的不斷溶解與沉淀。
2.4 CO2濃度
CO2濃度是影響CO2捕集過程中腐蝕行為和腐蝕速率的一個重要因素,CO2濃度增加可以大大提升溶液對碳鋼的腐蝕速率。這是因為隨著CO2負荷的增加,使反應式 (1) 和反應式 (8) 往右方向移動,形成更多的HCO3-和RNH3+[11],從而產生大量的H3O+需要被還原,加速了金屬的溶解。從極化曲線中可以看出,當CO2濃度升高時,陰極與陽極電流密度都要變大,且陰極電流密度變化更加明顯[8,10],表明CO2濃度的增加主要通過提高氧化劑的還原速率來提高腐蝕速率。Kladkaew等[7]提出,CO2濃度的升高導致鈍化區電流密度的升高,不利于鈍化膜的形成。
2.5 熱穩定鹽 (HSS)
MEA在吸收CO2過程中會發生氧化降解和熱降解[13],生成多種有機酸,如乙醇酸、丙酸、甲酸、草酸、醋酸等。這些酸在溶液中會形成胺鹽或者熱穩定鹽 (HSS),而胺鹽與熱穩定鹽一旦形成不可被降解并一直存在于裝置中[11],加速金屬腐蝕[14],腐蝕機理如式[15](15)、(16)。溶液中的Fe2+會與水結合形成Fe(H2O)62+,Fe(H2O)62+又會與熱穩定鹽陰離子反應生成絡合物,反應將向生成絡合物的方向移動,促進Fe的溶解形成Fe2+。

Tanthapanichakoon等[16]研究了不同熱穩定鹽以及熱穩定鹽的濃度對MEA-CO2溶液對碳鋼1018和304不銹鋼腐蝕性的影響,研究采用了六種熱穩定鹽 (草酸鹽、甲酸鹽、丙二酸鹽、乙醇酸鹽、丁二酸鹽、醋酸鹽),實驗溶液采用5.0 kmol/m3 MEA溶液,實驗溫度為80 ℃,CO2負荷為0.2 mol/mol MEA。研究發現,六種熱穩定鹽會促進MEA-CO2溶液對1018碳鋼的腐蝕,隨著鹽濃度升高腐蝕作用增強,其中草酸鹽對碳鋼腐蝕影響效果最大,丙二酸鹽次之,甲酸鹽第三。這3種鹽會改變陽極與陰極反應機理,并減慢鈍化膜的形成以及降低鈍化膜對金屬的保護作用,但可以擴大金屬處于鈍化區的電位區間。而乙醇酸鹽、丁二酸鹽、醋酸鹽對腐蝕影響要遠遠小于前3種鹽,并不會影響陰極與陽極的反應以及鈍化膜的形成和保護作用。除此之外,作者還提出這六種熱穩定鹽不會造成碳鋼的點蝕,也不會加劇MEA-CO2對304不銹鋼的腐蝕性。
哌嗪是一種環狀仲胺,由于其特殊的環狀胺結構,哌嗪可以更快速的與CO2反應形成氨基甲酸根[17]。工業上常在MEA溶液中加入哌嗪以提高CO2吸收速率[18]。Nainar等[19]研究了不同熱穩定鹽 (醋酸鹽、甲酸鹽、草酸鹽、硫代硫酸鹽) 對MEA與哌嗪混合溶液對碳鋼腐蝕性影響,研究結果表明,甲酸鹽是提升溶液腐蝕性能最強的熱穩定鹽,其次是醋酸鹽,最后是草酸鹽和硫代硫酸鹽;熱穩定鹽可以增強溶液的導電性可能是增強溶液腐蝕性能的原因之一。
Fytianos等[20]將5種熱穩定鹽所對應的有機酸 (乙醇酸、丙酸、甲酸、草酸、醋酸) 與質量分數30%MEA,CO2負荷0.4 mol/mol MEA溶液混合放置在316L不銹鋼管中,實驗溫度保持在135 ℃。腐蝕嚴重程度由大到小依次為草酸、丙酸、甲酸、醋酸、乙醇酸。該科研團隊所做實驗用鋼材雖然與上述Tanthapanichakoon團隊的不同,但是熱穩定鹽的腐蝕影響程度結果卻是一致的。
3 防腐措施
目前,應用緩蝕劑來解決CO2捕集過程中存在的腐蝕問題是最經濟、最靈活的方法,可以應用于現有固定的裝置設備,而不需要進行任何重大的工藝修改。
按照化學組成可以將緩蝕劑分為無機型緩蝕劑和有機型緩蝕劑[21]。針對工業醇胺捕集CO2系統,無機型緩蝕劑大部分為重金屬鹽,如釩、銻、銅、鈷、錫、硫等的化合物。有機型緩蝕劑一般為有機胺類與羧酸類[22]。由于有機型緩蝕劑的緩蝕效果普遍低于無機型緩蝕劑,工業捕集CO2時一般偏向于采用無機型緩蝕劑,其中偏釩酸鈉 (NaVO3) 是該系統中最常用緩蝕劑,最高可使抑制效果達97%。根據文獻記錄[23],在單乙醇胺 (MEA) 吸收酸性氣體裝置中加入1300 mg/kg的偏釩酸鈉后可使得金屬材質的腐蝕速率降低至0.0254 mm/a。但這些無機型緩蝕劑大多是劇毒,對于人體和環境都有很大的傷害,且處理費用高。硫代硫酸鈉是無機緩蝕劑中相對來說毒性偏低的。
Sureshkumar等[24]運用電化學阻抗評估了硫代硫酸鈉的緩蝕效率。腐蝕試樣采用1018碳鋼,實驗溶液采用濃度為5.0 kmol/m3 MEA的飽和CO2溶液,實驗中硫代硫酸鈉濃度為250~10000 mg/kg。實驗結果顯示添加硫代硫酸鈉短期內緩蝕效率可達91%~94%,其濃度變化所帶來的緩蝕效率變化甚微。然而,硫代硫酸根離子吸附在金屬表面,會引起鈍化膜不穩定,因此硫代硫酸鈉并不能起到長期緩蝕作用。
有機緩蝕劑毒性較低,近年來有學者開始研究其防腐效率。Veawab等[22]針對濃度為3.0 kmol/m3 MEA的飽和CO2溶液,在40 ℃至80 ℃的條件下,研究了有機型緩蝕劑的緩蝕效率。有機緩蝕劑芳香胺以及不同結構的含氮官能團的有機物,例如:咪唑、六亞甲基安、環己胺、二甲基吡啶,其腐蝕抑制率均低于60%。而長鏈脂肪胺、羧酸、亞砜等的腐蝕抑制率可高于75%。
4 結論
(1) MEA捕集CO2過程中生成氨基甲酸根離子、質子化胺以及CO2的水解是導致溶液具有腐蝕性的主要原因。
(2) 碳鋼在MEA-CO2溶液中存在電化學反應,陽極反應為碳鋼失電子溶解,陰極反應為游離水、H3O+、HCO3-得電子生成氫氣以及O2得電子還原成OH-。
(3) 影響MEA-CO2腐蝕體系的主要因素有:氧氣濃度、MEA濃度、CO2、溫度、熱穩定鹽,氧氣濃度升高、MEA濃度升高、CO2負荷增大、溶液溫度升高以及熱穩定鹽濃度升高,可使溶液腐蝕性增強。不同熱穩定鹽對溶液腐蝕性影響不同,其中草酸鹽對溶液腐蝕影響最大。
(4) 目前常用添加緩蝕劑來降低CO2捕集過程中的腐蝕,常用的無機緩蝕劑為偏釩酸鈉,腐蝕抑制效果達97%,但毒性高。毒性較低的硫代硫酸鈉的腐蝕抑制效果可達91%~94%,但不能起到長期緩蝕作用。有機緩蝕劑毒性較低,但腐蝕抑制效果普遍較低。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《中國腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62313558-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網官方QQ群:140808414





