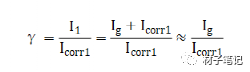概述
當兩種金屬或合金在介質中相互接觸時,電位較負的金屬或合金比它單獨處于腐蝕介質中時腐蝕速度增大,而電位較正的金屬或合金的腐蝕速度反而減小,得到一定程度的保護,這種腐蝕現象稱為電偶腐蝕,又稱為接觸腐蝕或異金屬腐蝕,參看圖1的電偶腐蝕示意。在電偶腐蝕現象中,電位較負的陽極性金屬腐蝕速度加大的效應,稱為電偶腐蝕效應;而電位較正的陰極性金屬腐蝕速度減小的效應,稱為陰極保護效應。在實際的工程應用中,采用不同的金屬、不同的合金、不同的金屬與合金的組合是不可避免的,因而發生電偶腐蝕也是不可避免的,同時也是一種常見的局部腐蝕形態。例如,加固金屬結構的鉚釘與金屬結構之間、鍍層金屬與基體金屬之間都會發生電偶腐蝕。另外需要注意的是,電偶腐蝕不單單指兩種金屬的接觸造成的腐蝕,某些金屬(如碳鋼)與某些非金屬的電子導體(如石墨材料)相互接觸時,也會產生電偶腐蝕。
電偶腐蝕的原理
兩種或兩種以上的金屬、金屬與非金屬的電子導體、同一金屬的不同部位,在腐蝕介質中互相接觸時由于存在腐蝕電位的不同,將會構成宏觀腐蝕電池,成為腐蝕電池的兩個電極,電子可以在兩個電極間直接轉移,而這兩個電極上進行的電極反應也將進行必要的調整,以滿足電極界面電荷的平衡關系。
以金屬在酸性溶液中的電偶腐蝕為例,當金屬M1和M2在酸性溶液中沒有相互接觸時,陰極過程都是氫去極化過程,腐蝕金屬電極上進行的相應電極反應為:
金屬M1:
M1 → M1n+ + ne
2H+ +2e → H2
金屬M2:
M2 → M2n+ + ne
2H+ +2e → H2
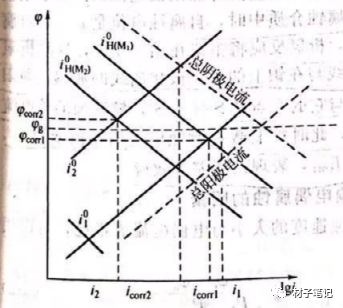
設金屬M1其自腐蝕電位為φcorr1,自腐蝕電流為icorr1;金屬M2的腐蝕電位為φcorr2,自腐蝕電流為icorr2。它們都處于活化極化控制,服從塔費爾關系,不妨設M1和M2兩金屬面積相等,M1的腐蝕電位比M2的腐蝕電位低,即φcorr1 << span="">φcorr2。當M1和M2在腐蝕介質中直接接觸時,由于二者電極電位不相同,便構成一個宏觀腐蝕電池,設這個宏觀電池中溶液的同一個電位,金屬M1電位由φcorr1向正方向移動,成為腐蝕電池的陽極,發生陽極極化,金屬M2的電位由φcorr2向負方向移動,成為腐蝕電池的陰極,發生陰極極化。當這個極化達到穩態時,兩條極化曲線的交點所對應的電位是金屬的共同的混合電位φg, φg處于之間,M1和M2之間互相極化的電流稱為電偶電流,用Ig表示。圖2為金屬M1和M2組成腐蝕電偶后的動力學極化示意。此處假設腐蝕電偶的陰極面積等于陽極面積。由圖可見,金屬M1的腐蝕速度從icorr1增加到i1,而金屬M2的腐蝕速度從icorr2降甽到i2。也就是說,組成電偶的兩金屬由于電偶效應的結果,使電位較正的陰極性金屬因陰極極化腐蝕速度減慢,從而得到一定程度的保護;而對于電位較負的陽極性金屬,因陽極極化,反而會加快腐蝕的速度。
M1和M2兩種金屬偶接后,陽極性金屬M1的腐蝕電流I1與未偶合時該金屬的自腐蝕電流icorr1之比,稱為電偶腐蝕效應系數,用γ表示。
式中,Icorr1表示M1未與M2偶接時的自腐蝕電流;I1表示M1與M2偶接后的腐蝕電流;Ig表示電偶電流。該公式表示,相接后陽極金屬M1溶解速度比金屬單獨存在時的腐蝕速度增加的倍數。γ越大,則電偶腐蝕越嚴重。
宏觀腐蝕電池對微觀腐蝕電池的影響
電位較負的金屬M1在與電位較正的金屬M2構成電偶后,受到了M2對它的陽極極化作用,通過了一個大小為Ig的凈的電偶電流,打破了它沒有與M2偶接時的自腐蝕狀態,同時在自腐蝕電位時建立的電荷平衡也被打破。同理,M2也由于與M1的偶接而打破了在自腐蝕電位時建立的電荷平衡。這說明宏觀腐蝕電池的作用將使微觀腐蝕電池的電流發生改變,這種效應稱為差異效應。如果宏觀電偶腐蝕電池使內部腐蝕微電池電流減少,則此效應為正差異效應;相反,如果引起內部腐蝕微電池電流增加,則稱為負差異效應。
正差異效應可以通過鋅在稀硫酸中和鉑接觸的實驗來驗證。首先,當鋅單獨存在時,收集腐蝕產生的氫氣,在一定時間內收集的氫氣的體積正比于鋅的腐蝕速度,設其為V0。然后,將鋅和鉑在硫酸中用外部的導線連接,分別收集相同時間內鋅和鉑產生的氫氣V1和 V2。V1相當于鋅和鉑組成電偶后受到鉑陽極極化后腐蝕微電池的腐蝕速度。由于鉑單獨存在時在稀硫酸中不會產生析氫腐蝕,則V2相當于鋅和鉑接觸后組成的宏觀腐蝕電池的腐蝕速度。鋅和鉑接觸后,總的腐蝕速度應等于微觀腐蝕電池腐蝕速度V1與宏觀腐蝕電池腐蝕速度V2之和。實驗觀察,雖然V1+V2大于V0,但V1卻比V0小。這說明鋅受到陽極極化后,它本身的腐蝕微電池電流減少了,所以產生了正差異效應。差異效應的實質是宏觀腐蝕電池和金屬內部微觀腐蝕電池相互作用的結果,宏觀電池的工作引起微電池工作的削弱正是正差異效應的現象。如果用鋁來代替鋅重復上述實驗,發現不僅鋁的總腐蝕速度增加,而且鋁的微電池的腐蝕速度亦增加,這就是負差異效應的現象。
差異效應的現象,可用短路的多電極電池體系的圖解方法進一步解釋。將腐蝕著的金屬看成雙電極腐蝕電池,當鋅和鉑接觸,即等于接入一個更強而組成一個三電極腐蝕電池,假定電極的面積比以及它們的陰極、陽極極化曲線可以確定的話,便可以給出體系差異效應的腐蝕極化曲線,如下圖所示。在這個三電極體系中,鉑可視為不腐蝕電極,對鋅來說,除了未與鉑接觸時由于微電池作用而發生自溶解外,還因外加陽極電流而產生了陽極溶解,所以它的總腐蝕速度增加了。當鋅單獨處于腐蝕介質中時,自腐蝕電位是φcorr,自腐蝕電流是Icorr。當把鉑接入后,由于鉑的電位較正,析氫反應將主要在鉑上發生,這是析氫的總的陰極化曲線應該是在鋅表面析氫的極化曲線與在鉑上的析氫極化曲線的加和,即陽極極化曲線與它的交點從S變為S’,鋅腐蝕的總電流也變為Icorr’,此時鋅上微觀腐蝕電池的電流變為I1,小于原來的Icorr,表現出正差異效應。
影響電偶腐蝕速度的因素
①金屬材料的電位差值
電偶腐蝕與相互接觸的金屬在溶液中的電位有關,因此構成了宏觀腐蝕原電池,組成電偶的兩個金屬的電位差是電偶腐蝕的推動力。如果穩定電位起始電位差越大,則電偶腐蝕傾向也越大,即Ig越大,陽極腐蝕加速。
在電化學中使用標準電位序來比較不同金屬材料間電位高低及差距,它是按金屬元素標準電極電位的高低次序排列的次序表,是從熱力學公式計算出來的,該電位是指金屬在活度為1的該金屬鹽溶液中的平衡電位。而實際情況下,金屬通常不是純金屬或者以合金形式存在,其表面狀態也不同于理想的情況,如表面帶有氧化膜等,并且腐蝕介質溶液成分復雜,因此標準電位序在實際使用中并不適合,在電偶腐蝕研究中常應用電偶序來判斷不同金屬材料接觸后的電偶腐蝕傾向。
電偶序是指在具體使用腐蝕介質中,金屬和合金穩定電位的排列次序表。表1為海水中金屬與合金的電偶序。由表可見,如電位高的金屬材料(表上部的金屬或合金)與低電位金屬材料(表下部的金屬或合金)互相接觸,則低電位的成為陽極,被加速腐蝕,且兩者之間電位差越大(在電偶序表中相距越遠),則低電位的金屬腐蝕速度越快。
無論標準電位序還是電偶序都只能反映一個腐蝕傾向,不能表示出實際的腐蝕速度。有時某些金屬在具體介質中接觸后可能發生極性的轉換,雙方電位可以發生逆轉。例如,鋁和鎂在中性氯化鈉溶液中接觸,開始時鋁比鎂電位正,鎂為陽極發生溶解,之后由于鎂的溶解而使介質變為堿性,這時電位發生逆轉,鋁變成了陽極,所以電動序與電偶序都有一定的局限性。金屬的電偶序因介質條件不同而異,所以電偶序總是要規定在什么環境中才適用,實踐中應用的不但有海水的電偶序,還有土壤中的電偶序以及某些化工介質中的電偶序等。
②極化作用
不論是使陽極極化率增大還是使陰極極化率增大,都有利于使電偶腐蝕電流降低。例如,在海水中不銹鋼與碳鋼的陰極反應都是受氧的擴散控制,當這兩種金屬偶接以后,不銹鋼由于鈍化使得陽極極化率比碳鋼高得多,所以偶接后不銹鋼能夠強烈加速碳鋼的腐蝕。再比如,在海水中不銹鋼與鋁組成的電偶對比銅與鋁組成的電偶對腐蝕傾向小,這兩對電偶的電位差值相差不多,陰極反應都是氧分子的去極化過程,但是因為不銹鋼有良好的鈍化膜,陰極反應只能在膜的薄弱處進行,陰極極化率高,陰極反應相對難以進行,而銅鋁組成的電偶對的銅表面氧化物能被陰極還原,陰極反應容易進行,陰極極化率小,故而電偶腐蝕效應嚴重得多。
電偶體系的歐姆電阻也會對電偶電流產生影響,電阻越大,電偶腐蝕速度越小。實際中觀察到,電偶腐蝕主要發生在兩種不同金屬或金屬與非金屬導體相互接觸的邊線附近,而在遠離邊緣的區域,其腐蝕程度要輕得多。這就是因為由于電流流動要克服電阻的作用,距離電偶的接合部位愈遠,相應的腐蝕電流密度越小,所以溶液電阻大小影響電偶的“有效作用距離”,電阻越大則“有效作用距離”越小,因而陽極金屬腐蝕電流呈不均勻的分布。例如,在蒸餾水中,腐蝕電流有效距離只有幾厘米,使陽極金屬在接合部附近形成深的腐蝕溝,而在海水中,電流的有效距離可達幾十厘米,陽極電流的分布就比較均勻不會發生特別嚴重的陰陽極接觸部位的腐蝕。
表1 常見金屬在海水中電偶序
③陰陽極面積比
陰陽極面積變大,使得電偶腐蝕電流變大,但實際中更重要的因素是陰陽極之間的面積比。電偶腐蝕電池的陽極面積減小,陰極面積增大,將導致陽極金屬腐蝕加劇,這是因為電偶腐蝕電池工作時陽極電流總是等于陰極電流,陽極面積愈小,則陽極上電流密度就愈大,即金屬的腐蝕速度愈大。在局部腐蝕過程中,由于陽極電流和陰極電流的不平衡,使得金屬表面一些局部區域具有較高的陽極溶解電流,面其余表面的區域則具有較大的陰極還原電流,陽極反應和陰極反應發生在不同的部位,因此腐蝕金屬表面的陰陽極面積比對所觀測到的局部腐蝕速率有較大的影響。陰陽極面積比影響局部腐蝕速度的一個典型的例子,就是銅板使用鐵鉚釘加固和鐵板使用銅鉚釘加固分別產生了不同的效果。銅的電位比鐵正,所以銅板裝上鐵鉚釘后,由于構成了大陰極小陽極的電偶腐蝕,使鐵鉚釘很快被腐蝕掉,然而鐵板裝上銅鉚釘使鐵板的腐蝕增加并不多。
在腐蝕過程中,尤其是實際的金屬結構件中,若形成了大陰極/小陽極的情況,陽極區域將具有很高的陽極溶解速度,這往往導致強烈的局部腐蝕,并導致材料失效。例如,在鋼鐵材料表面上若鍍覆有陰極性金屬鍍層,如果金屬鍍層存在針孔或金屬鍍層的腐蝕產生了針孔或鍍層發生破損,使得在針孔或破損處裸露出金屬基體,由于金屬基體的電位較金屬鍍層低,在與腐蝕介質相接觸時,針孔或破損處的金屬基體作為陽極區發生了陽極溶解,而陰極去極化劑的反應發生在金屬鍍層表面,此時構成了典型的大陰極小陽極偶對,使局部腐蝕在針孔或破損處以很高的速度進行,形成鍍層下的腐蝕坑。陰陽極面積比對局部腐蝕影響的現象不僅出現在不同金屬偶接上,而且也出現在同種金屬表面由于各種因素引起的電化學不均勻性上。如點腐蝕孔中的陽極區與孔外陰極區、縫隙腐蝕中的陽極區與縫隙外陰極區、金屬表面磨損區的陽極區與未被磨損區的陰極區等,都能構成小陽極大陰極的電偶腐蝕,從而使金屬的局部腐蝕加速。
防止電偶腐蝕的措施
1)組裝構件應盡量選擇在電偶序表中位置相近的金屬。由于對于特定的使用介質不定有現成的電偶序,所以應該預先進行必要的電偶腐蝕實驗。
2)對于不同金屬構成的結構部件應該盡量避免形成大陰極小陽極的接觸結角
3)采用絕緣材料或保護性阻擋涂層分隔電偶腐蝕的接觸部位。不同金屬部件之間絕緣,可以有效地防止電偶腐蝕。
4)采用電化學保護。即可以使用外加電源對整個設備實行陰極保護,使兩種金屬都變為陰極,也可以安裝一塊電極電位比兩種金屬更負的第三種金屬作為犧性陽極。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414