摘 要:目的 研究P110S 低合金鋼在H2S/CO2 環境中的腐蝕行為及腐蝕產物對其影響機理。方法 通過P110S 低合金鋼在不同溫度下的腐蝕失重實驗、微觀SEM 形貌觀察、XRD 分析和離子選擇性實驗,探究腐蝕產物的晶體結構以及離子選擇性對腐蝕行為的影響。腐蝕實驗環境為模擬我國西北某油田現場不同井深的腐蝕工況,其中CO2 與H2S 的分壓比為2.5。結果 溫度低于100 ℃時,腐蝕產物主要為馬基諾礦型FeS,其為陽離子選擇性,能夠阻礙陰離子與基體接觸,起到抑制腐蝕的作用,因此腐蝕速率較低,約為0.15 mm/a,且隨溫度升高基本保持不變,試樣表面的腐蝕產物膜平整未脫落;溫度達到120 ℃后,腐蝕速率急劇增大,部分腐蝕產物由馬基諾礦轉變為磁黃鐵礦,腐蝕產物膜因下層腐蝕產物擠壓而發生破裂脫落,試樣發生局部腐蝕;溫度高于160 ℃時,腐蝕產物全部為磁黃鐵礦型FeS,其為陰離子選擇性,無法阻礙陰離子穿過腐蝕產物膜與基體接觸,因此隨著溫度的升高,腐蝕速率逐漸增大并趨于平緩,達到3.6 mm/a。結論 H2S/CO2 環境中低合金鋼腐蝕行為與腐蝕產物晶體構型及離子選擇性密切相關,若腐蝕產物為馬基諾礦型FeS 時,其具有陽離子選擇性,能夠抑制金屬基體腐蝕溶解;而若腐蝕產物為磁黃鐵礦型FeS 時,因其具有陰離子選擇性,則不能抑制金屬基體發生腐蝕溶解。
關鍵詞:H2S/CO2 腐蝕;腐蝕產物;離子選擇性;溫度;低合金鋼
含硫油氣藏已經逐漸成為油氣工業開采的主力,其中伴生的酸性氣體H2S 不但會導致碳鋼發生應力腐蝕開裂現象,還會使金屬發生嚴重的腐蝕失重,甚至點蝕,直接威脅油氣生產安全,因此H2S 腐蝕問題一直被研究者們所關注。
在腐蝕環境中,金屬表面腐蝕產物的形成將直接影響腐蝕的進程[1-5]。碳鋼在H2S 腐蝕環境下的腐蝕產物為硫化亞鐵,由于溫度、壓力或者pH 值的不同,導致碳鋼在不同環境下形成的硫化亞鐵具有不同的晶體結構,例如四方薄片狀馬基諾礦(MackinawiteFeS)、立方硫鐵礦(Cubic FeS)、單斜/六方磁黃鐵礦(Pyrrhotite Fe1–xS)、六方隕鐵礦(Troilite FeS)和正交黃鐵礦(Pyrite FeS2)[6-7]。不同晶體結構的硫化亞鐵構成的腐蝕產物膜對鋼鐵腐蝕行為的影響有明顯區別[8],導致H2S 環境中的腐蝕機理更復雜,而H2S與CO2 共存時的腐蝕機理將更加復雜。孫喬[9]從離子選擇性角度研究了腐蝕產物對低合金鋼腐蝕速率的影響,發現低溫時生成的隕鐵礦為陽離子選擇性,腐蝕速率較低且伴隨著均勻腐蝕的發生;而高溫下生成的馬基諾礦為陰離子選擇性,腐蝕速率較高,這說明腐蝕產物的離子選擇性會影響腐蝕速率。Sato[10]提出了腐蝕產物具有離子選擇性,從離子遷移角度對腐蝕產物影響腐蝕行為的機制進行討論。后續的研究也表明,腐蝕產物的離子選擇性是影響腐蝕行為的重要因素[11-12]。因此研究硫化亞鐵晶體結構、離子選擇性和腐蝕行為之間的關系,有助于進一步理解硫化氫對金屬腐蝕的機制。
本文以油氣田常用的P110S 低合金鋼為研究對象,對其在H2S/CO2 環境下的腐蝕行為進行研究。通過高溫高壓腐蝕實驗獲得了P110S 在不同溫度下的腐蝕速率、腐蝕形貌以及腐蝕產物組成,并結合點蝕坑截面結構和元素分布,以及腐蝕產物的離子選擇性,對P110S 腐蝕行為隨溫度變化的機制進行討論。
1 實驗
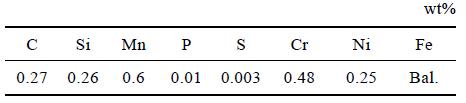
實驗所用材料為油氣田廣泛應用的P110S 油管材料,其合金元素組成如表1 所示。
表1 P110S 的元素組成
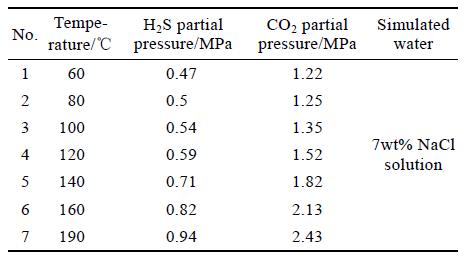
實驗采用高溫高壓動態腐蝕試驗方法,掛片尺寸(長×寬×厚)為50 mm×10 mm×3 mm。實驗前,依次用120#、400#、800#砂紙打磨后,將試片浸沒在丙酮中超聲清洗并吹干,再用游標卡尺測量尺寸并用電子天平稱量。實驗時將試樣掛載于動態高溫高壓反應釜中,實驗周期為7 d。腐蝕實驗環境為模擬我國西北某油田現場不同井深的腐蝕工況,工況參數見表2,其中CO2 與H2S 的分壓比基本保持不變,為2.5。采用美國FEI 公司的場發射環境掃描電鏡(Quanta200 FEG)對腐蝕后的試樣進行形貌觀察,采用BrukerD8 X-射線衍射儀對腐蝕產物組分進行分析。
表2 不同溫度的腐蝕失重實驗條件
腐蝕產物的膜電位測量是一種常用的表征腐蝕產物離子選擇性的手段。首先,將試樣上的腐蝕產物逐層刮取置入丙酮中,再使用超聲波震蕩使腐蝕產物分散均勻;然后,將腐蝕產物加入溶有醋酸纖維素的丙酮中,當丙酮全部自然揮發后,便可獲得以醋酸纖維素為骨架的腐蝕產物膜。
根據Miyuki 的方法[13]進行膜電位測試,測試在室溫(25 ℃)下進行。圖1 為膜電位的測量裝置示意圖。如圖所示,膜放置于兩個容器的中間,左側容器中的溶液依次為0.0001、0.001、0.01、0.1、1 mol/L氯化鉀溶液,右側容器中的溶液為0.01 mol/L 氯化鉀溶液。當左右兩側容器中的氯化鉀溶液濃度不同時,由于膜的離子選擇性,在膜中遷移的陰陽離子數目將不同,此時膜的左右兩側會出現電勢差,此電勢差成為膜電位。使用兩個飽和甘汞電極可以測量此電勢差。
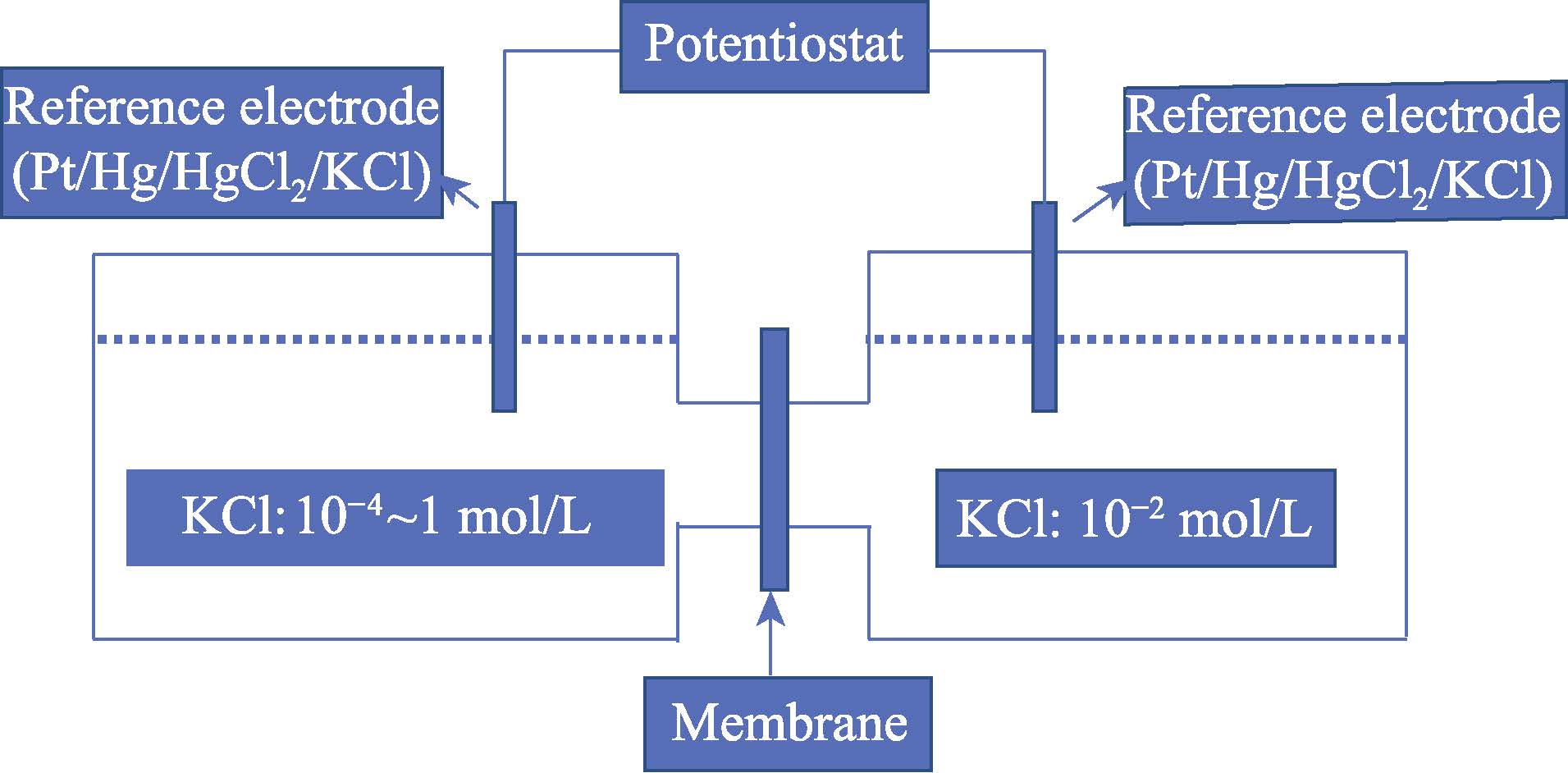
圖1 膜電位的測量裝置示意圖
2 結果及分析
2.1 腐蝕速率
圖2 為在不同溫度H2S/CO2 腐蝕環境下低合金鋼P110S 的腐蝕速率,總體來看,P110S 的腐蝕速率隨著溫度的升高而增加。以往的研究結果表明,CO2 腐蝕環境下,低合金鋼的腐蝕速率會隨著溫度的升高,先上升后下降,其中腐蝕速率的最大值一般出現在60~ 80 ℃范圍內[14-16]。而圖2 中在60~190 ℃溫度區間內,腐蝕速率持續增加,不符合CO2 腐蝕特征,因此在CO2 與H2S 分壓比為2.5 的條件下,P110S 的腐蝕不由CO2 腐蝕控制。特別值得注意的是,當溫度小于100 ℃時,P110S 的腐蝕速率幾乎保持不變,腐蝕速率維持在0.15 mm/a 附近;而當溫度進一步升高至120 ℃時,P110S 的腐蝕速率顯著增加至 0.52mm/a,并且隨著溫度的升高,腐蝕速率繼續快速增加,在190 ℃時高達3.61 mm/a。
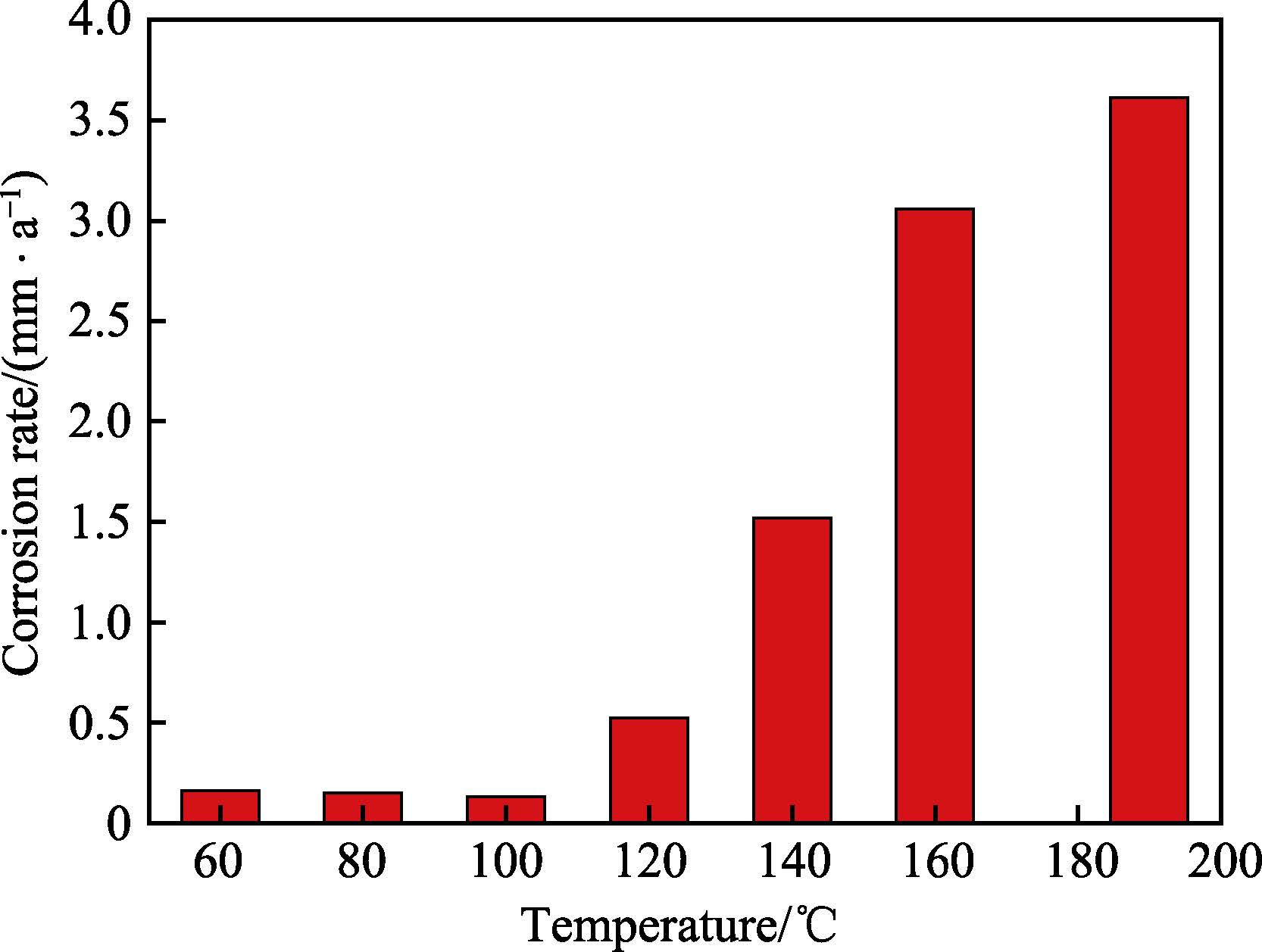
圖2 不同溫度條件下P110S 的腐蝕速率
2.2 宏觀腐蝕形貌
圖3 為P110S 在不同溫度下的宏觀腐蝕形貌。當溫度低于100 ℃時,試樣表面腐蝕較輕,整體上覆蓋完整;當腐蝕溫度升高至120 ℃時,試樣表面的腐蝕產物膜出現鼓包現象,并且腐蝕產物膜形成的鼓包開始破裂,試樣表面形成了局部腐蝕;當腐蝕溫度升高至140 ℃時,腐蝕產物開始明顯變厚且顏色變深,腐蝕產物膜導致的鼓包數量也開始有所增加;而當溫度升高至160 ℃時,試樣腐蝕進一步加劇,腐蝕產物膜形成的鼓包數量繼續增多且分布均勻;當溫度為190 ℃時,試樣表面的鼓包現象最嚴重,鼓包尺寸比較大,腐蝕情況最嚴重。
2.3 微觀腐蝕形貌
圖4 為P110S 在不同溫度下的腐蝕產物膜微觀形貌。當溫度為60 ℃和100 ℃時,試樣表面的腐蝕產物平整,雖然在局部小區域內發生了輕微的脫落,但整體上覆蓋完整;當腐蝕溫度升至120 ℃時,試樣表面的腐蝕產物膜出現鼓包,并且在鼓包狀的腐蝕產物膜脫落處,金屬基體發生明顯的局部腐蝕;當腐蝕溫度升高至140 ℃時,腐蝕產物開始明顯增厚,鼓包狀腐蝕產物膜的數量也開始顯著增加,鼓包現象愈發嚴重;而當溫度升高至160 ℃時,試樣表面的腐蝕產物開始發生大面積的分層、脫落。值得注意的是,190 ℃時,試樣表面每個鼓包狀的腐蝕產物膜上出現了由晶體構成的同心環狀結構。

圖3 P110S 腐蝕后的宏觀形貌

圖4 不同溫度下P110S 的微觀腐蝕形貌(c 中右上角圖片為鼓包狀腐蝕產物破裂的形貌)
當溫度為60 ℃和100 ℃時,試樣表面形成的腐蝕產物未呈現出明顯的晶體形狀;而當腐蝕溫度提高至140 ℃以上時,腐蝕產物呈現出規則的晶體形狀,為六邊片狀結構,見圖5a 所示。圖5a、b 為形成在鼓包狀的腐蝕產物膜內部的晶體形態,腐蝕產物由六邊片狀晶體交織而成,且每片晶體的厚度較薄,僅為36 nm。而在190 ℃,形成于鼓包狀的腐蝕產物膜外的六邊形晶體則發育較好,個體尺寸較大,厚度可大于1 μm。這種發育良好的六邊形片狀晶體僅形成在鼓包狀的腐蝕產物膜的圓周上,并且呈現同心環狀分布,應與鼓包狀的腐蝕產物膜的生長有關。
2.4 腐蝕產物組成
圖6 為P110S 在不同腐蝕溫度下形成的腐蝕產物的XRD 圖譜。實驗結果表明,P110S 在CO2 與H2S分壓比為2.5 的腐蝕環境中形成的腐蝕產物不含有FeCO3,均為鐵的硫化物。當腐蝕溫度小于100 ℃時,P110S 表面的腐蝕產物由馬基諾礦組成,其中當溫度為60 ℃時,腐蝕產物中還含有部分的立方硫鐵礦,其可能是由馬基諾礦轉變而成;當腐蝕溫度升高至120 ℃時,腐蝕產物中開始出現磁黃鐵礦,并且隨著溫度的進一步升高,磁黃鐵礦的含量不斷增加;當溫度達到190 ℃時,腐蝕產物完全由磁黃鐵礦組成。因此馬基諾礦向磁黃鐵礦轉變的溫度為120 ℃,完全轉變溫度為190 ℃。結合前文的試驗結果,腐蝕速率、腐蝕產物形貌隨溫度轉變的規律相一致,因此P110S 的腐蝕過程受試樣表面形成腐蝕產物類型的控制。

圖5 不同溫度條件下P110S 腐蝕形貌的微觀SEM 形貌
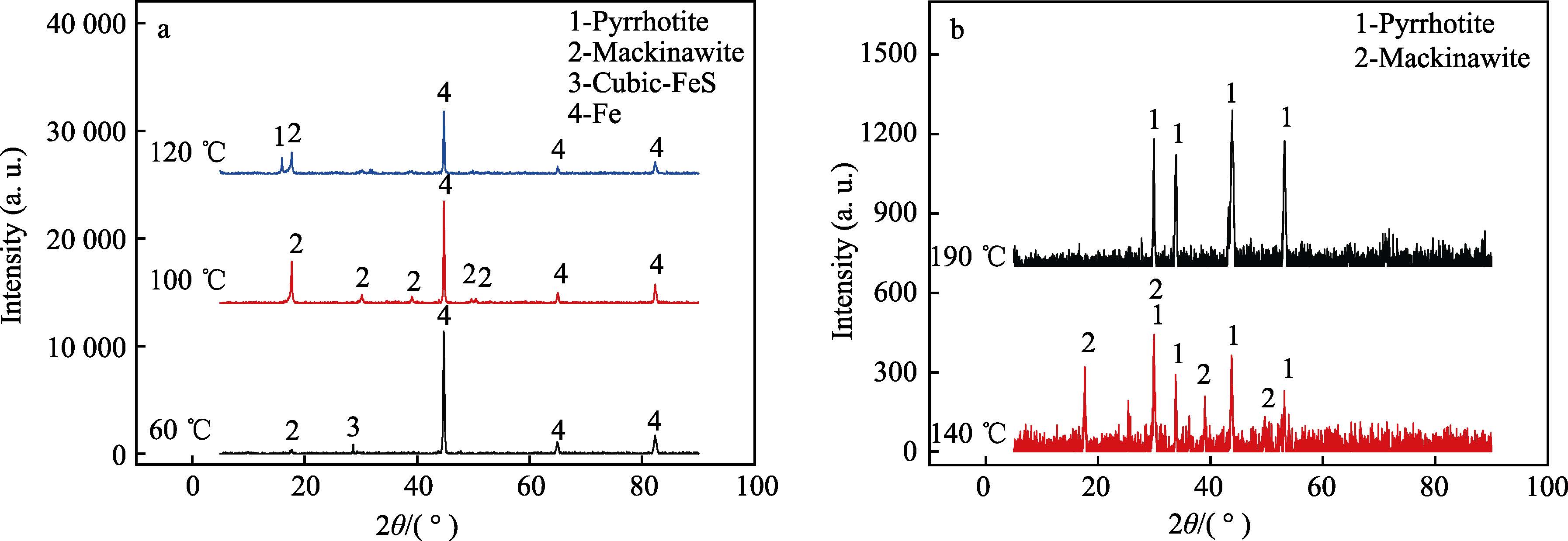
圖6 不同溫度下P110S 腐蝕產物的XRD 圖譜
2.5 腐蝕產物截面
圖7 為190 ℃腐蝕環境下腐蝕產物膜形成鼓包的截面形貌以及腐蝕產物的元素分布。結果表明,在鼓包的下方金屬基體形成點蝕,并且在點蝕坑底部存在無腐蝕產物填充的空腔。蝕坑內的腐蝕產物由Fe、S、O 和Cl 元素組成,其中O 元素的含量較少。根據點蝕坑內元素的分布,可以發現坑內腐蝕產物分為兩層:上層是由Fe 和S 元素組成的磁黃鐵礦層,其分布區域見圖7 中S 元素分布范圍;而下層則主要由Fe、Cl 和O 元素組成,其分布區域見圖7 中Cl 和O元素的分布范圍。Cl 元素主要分布在點蝕坑底部,且含量明顯增高,這是點蝕生長自催化酸化機制的重要特征[17-18],同時點蝕坑底部也有空腔形成,這都表明腐蝕產物膜導致的鼓包下的點蝕坑內一直處在快速酸性活化溶解狀態。
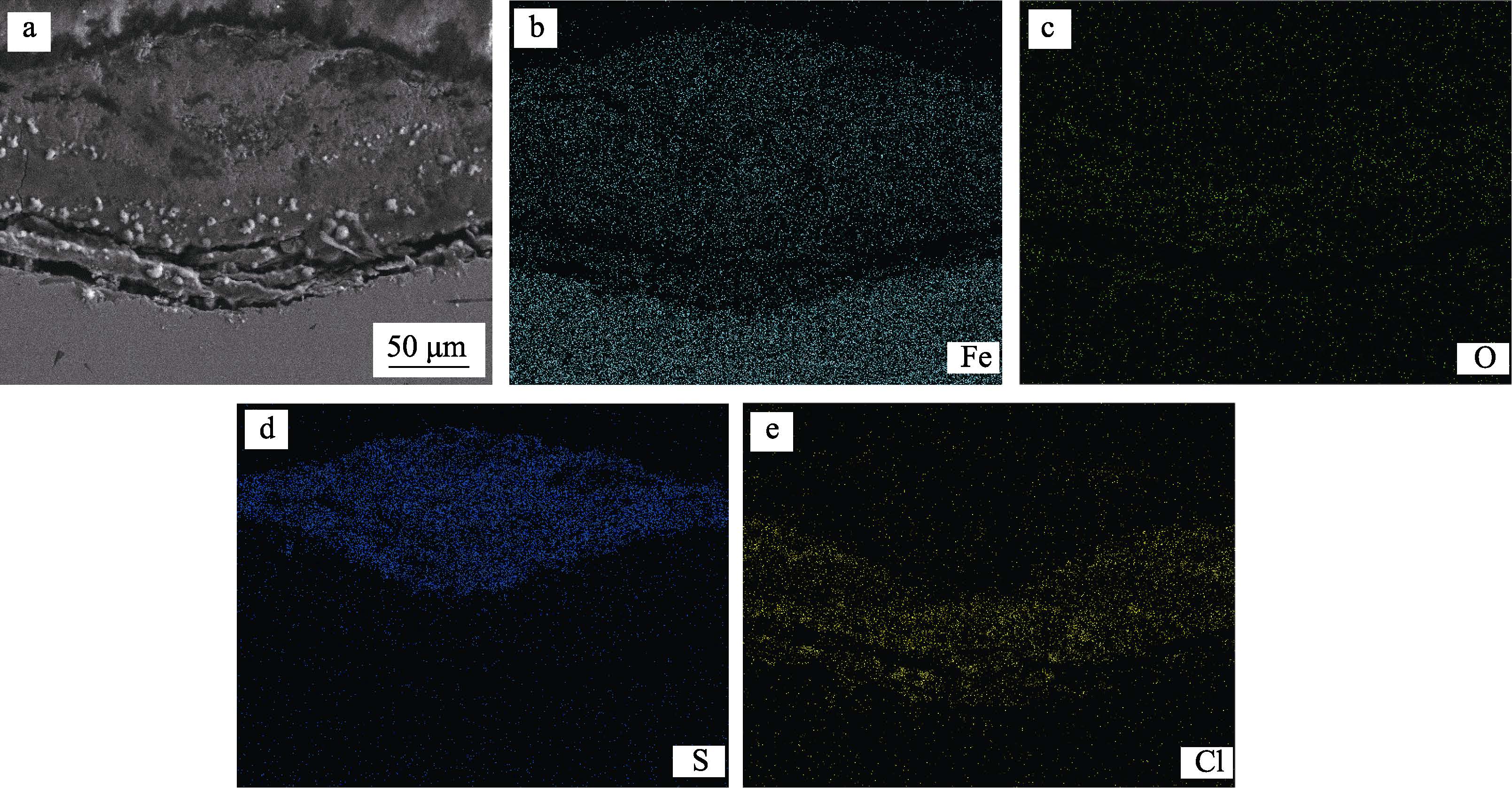
圖7 190 ℃鼓包狀腐蝕產物的截面形貌及元素分布
2.6 腐蝕產物離子選擇性
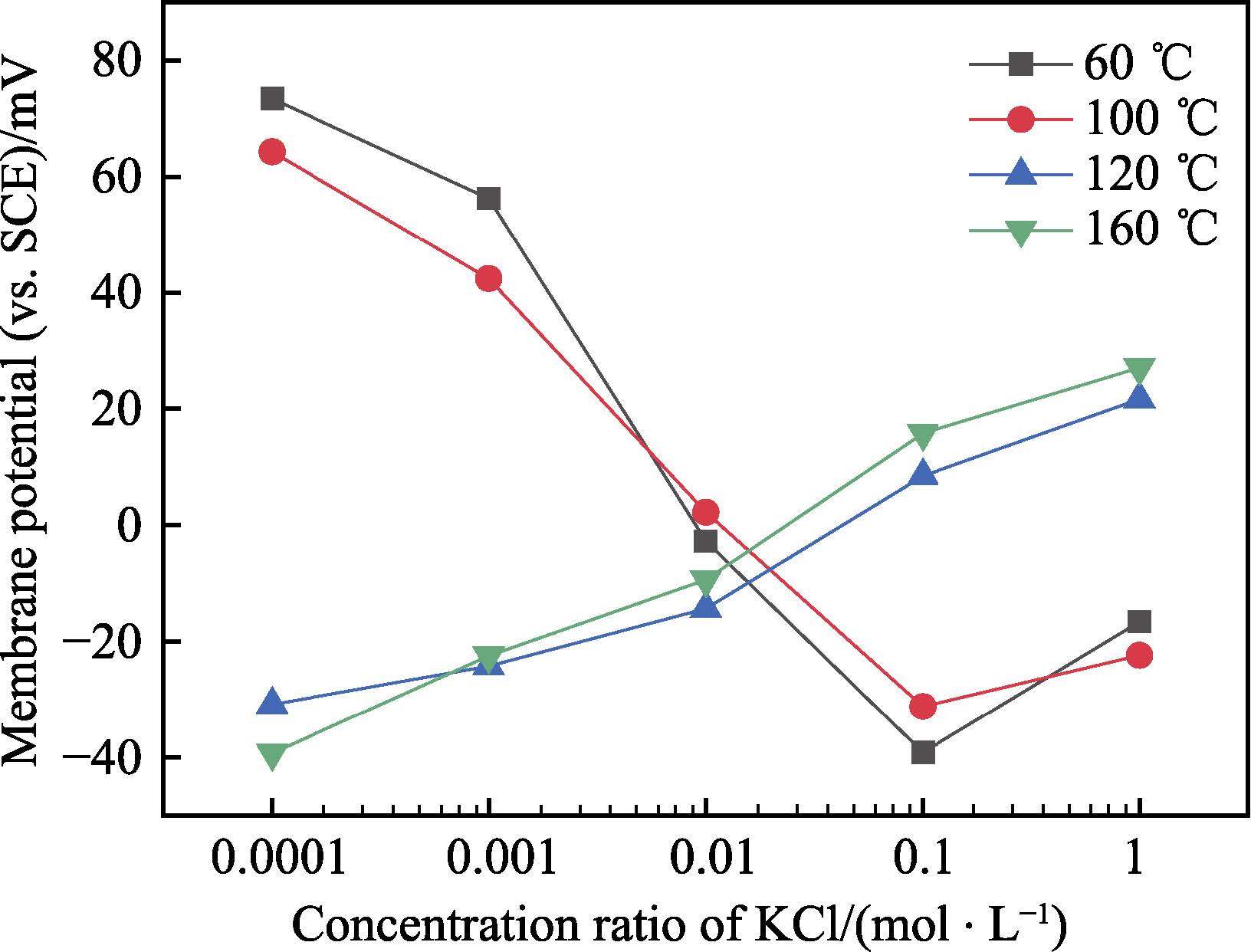
腐蝕產物通常具有離子選擇性,將影響溶液和基體金屬表面之間的離子傳輸,進而影響金屬基體的腐蝕過程。膜電位試驗是表征腐蝕產物離子選擇性最常用的實驗方法。圖8 為60、100、120、160 ℃下腐蝕產物的膜電位隨KCl 濃度變化的曲線,結果表明,形成于60 ℃和100 ℃的腐蝕產物的曲線斜率為負,而形成于120 ℃和160 ℃的腐蝕產物的曲線斜率為正。曲線斜率為正表示腐蝕產物具有陰離子選擇性,而曲線斜率為負表示腐蝕產物具有陽離子選擇性。值得注意的是,腐蝕速率在100 ℃和120 ℃之間出現了拐點,而與之同時腐蝕產物的離子選擇性也發生了轉變,由馬基諾礦轉變為磁黃鐵礦膜電位的結果表明。膜電位和XRD 的實驗結果表明,形成于較低溫度的馬基諾礦具有陽離子選擇性,而形成于較高溫度的磁黃鐵礦具有陰離子選擇性。
圖8 不同溫度下腐蝕產物膜的離子選擇性
3 討論
腐蝕環境中CO2 與H2S 分壓之比為2.5 時,不同于CO2 腐蝕,P110S 的腐蝕速率始終隨著溫度的升高而增加(圖2),且在各溫度下形成的腐蝕產物都為鐵的硫化物,不含有FeCO3(圖6),表明腐蝕過程一直受H2S 腐蝕控制。當腐蝕溫度為120 ℃時,P110S的腐蝕速率、腐蝕形態以及腐蝕產物的組成都發生了明顯的改變;當溫度低于120 ℃時,腐蝕產物為單一的馬基諾礦;而當溫度高于120 ℃時,腐蝕產物則向磁黃鐵礦轉變;當溫度到達190 ℃時,腐蝕產物中不再含有馬基諾礦,完全由磁黃鐵礦組成。腐蝕產物為馬基諾礦時具有陽離子選擇性,能夠阻止溶液中的陰離子進入到腐蝕產物內。而腐蝕產物中有磁黃鐵礦生成時,腐蝕產物的離子選擇性會轉變為陰離子選擇性,使得陰離子能夠穿過腐蝕產物到達金屬基體表面,并在此處聚集。高濃度的Cl–造成嚴重局部酸化,導致金屬基體處于活化溶解狀態,從而導致點蝕的形成。因此,腐蝕產物離子選擇性的轉變是P110S在高溫環境腐蝕速率快速增加和發生點蝕的主要原因。
腐蝕產物的離子選擇性不但影響著P110S 的腐蝕速率,還直接影響著腐蝕產物的形貌。當腐蝕溫度小于120 ℃時,陽離子選擇性的腐蝕產物會阻止陰離子遷移,因此只能由Fe2+從金屬基體表面遷移穿過腐蝕產物層,與溶液中的陰離子結合形成新的腐蝕產物,此時腐蝕產物的生長方向指向溶液,為向外生長。新的腐蝕產物在原有腐蝕產物上逐層生長,最終在試樣表面形成平整的腐蝕產物層。而當溫度高于120 ℃時,陰離子選擇性的腐蝕產物阻擋了Fe2+遷移,此時只能由陰離子遷移穿過腐蝕產物,在金屬基體和腐蝕產物的界面處形成新的腐蝕產物層,此時腐蝕產物的生長方向指向金屬基體,為向內生長。一旦Cl–在局部聚集造成酸化,金屬加速溶解,腐蝕產物就會快速增厚,導致鼓包狀腐蝕產物的形成,并且底層腐蝕產物快速增加會導致上層腐蝕產物開裂。腐蝕產物一旦開裂,之前被限制在腐蝕產物下的Fe2+會遷移到開裂處,與溶液中S2–結合形成磁黃鐵礦。由于此時陰、陽離子遷移都不再受到阻礙,生成的磁黃鐵礦能夠快速生長,形成的晶粒尺寸較大,如圖4f 和圖5c 所示。但是當磁黃鐵礦生長到一定程度時,就會封堵腐蝕產物的裂口,使腐蝕產物回到向內生長的模式,直到下一次腐蝕產物層破裂。隨著腐蝕產物不斷開裂,就會在鼓包處形成同心的磁黃鐵礦晶體環(如圖4f 所示)。
4 結論
1)當溫度在100 ℃以下時,隨著溫度的升高,P110S 低合金鋼的腐蝕速率基本不變;溫度在120 ℃至160 ℃之間時,隨著溫度的升高,腐蝕速率急劇上升,在160 ℃時達到3 mm/a;繼續升高溫度,腐蝕速率緩慢上升并保持在一個較高水平。
2)腐蝕產物的晶體構型和腐蝕產物膜形貌與溫度密切相關。溫度低于100 ℃時,腐蝕產物為馬基諾礦,腐蝕產物膜平整致密,無脫落現象。溫度上升至120 ℃時,腐蝕產物部分由馬基諾礦轉變為磁黃鐵礦,腐蝕產物膜局部區域發生鼓包脫落,基體發生局部腐蝕,隨著溫度的升高,腐蝕產物中磁黃鐵礦含量增加,腐蝕產物膜鼓包脫落愈發嚴重。當溫度升高至190 ℃時,腐蝕產物全部為磁黃鐵礦。
3)馬基諾礦為陽離子選擇性,能夠阻止溶液中陰離子穿過其組成的腐蝕產物膜,因此當溫度低于100 ℃時,腐蝕速率較低。而磁黃鐵礦為陰離子選擇性,溶液中的陰離子能夠輕易穿過其構成的腐蝕產物膜,并與金屬基體接觸,使金屬發生腐蝕溶解,因此當溫度升高至120 ℃后,P110S 的腐蝕速率隨溫度升高而增大,當溫度升高至190 ℃時,腐蝕產物已全部轉變為磁黃鐵礦,因此其腐蝕速率保持在高水平。
參考文獻:
[1] SMITH J S, MILLER J D. Nature of sulphides and theircorrosive effect on ferrous metals: A review[J]. Britishcorrosion journal, 1975, 10(3): 136-143.
[2] BAI Peng-peng, ZHAO Hui, ZHENG Shu-qi, et al. Initiationand developmental stages of steel corrosion in wetH2S environments[J]. Corrosion science, 2015, 93: 109-119.
[3] ZIMER A M, DE CARRA M A, RIOS E C, et al. Initialstages of corrosion pits on AISI 1040 steel in sulfidesolution analyzed by temporal series micrographs coupledwith electrochemical techniques[J]. Corrosion science,2013, 76: 27-34.
[4] TANG Jun-wen, SHAO Ya-wei, GUO Jin-biao, et al. Theeffect of H2S concentration on the corrosion behavior ofcarbon steel at 90 ℃[J]. Corrosion science, 2010, 52(6):2050-2058.
[5] MORSE J W, MILLERO F J, CORNWELL J C, et al. Thechemistry of the hydrogen sulfide and iron sulfide systems innatural waters[J]. Earth-science reviews, 1987, 24(1): 1-42.
[6] RICKARD D, LUTHER G W. Chemistry of iron sulfides[J].Chemical reviews, 2007, 107(2): 514-562.
[7] WEN Xiang-li, BAI Peng-peng, LUO Bing-wei, et al. Reviewof recent progress in the study of corrosion products ofsteels in a hydrogen sulphide environment[J]. Corrosionscience, 2018, 139: 124-140.
[8] 范亞萍, 周怡諾. 不同溫度下H2S/CO2 腐蝕產物膜對T95 套管腐蝕行為的影響[J]. 表面技術, 2016, 45(10):180-186.FAN Ya-ping, ZHOU Yi-nuo. Effects of H2S/CO2 corrosionscale on corrosion behavior of T95 casing steel at differenttemperature[J]. Surface technology, 2016, 45(10): 180-186.
[9] SUN Q, CHEN C F, ZHAO X, et al. Ion-selectivity ofiron sulfides and their effect on H2S corrosion[J]. Corrosionscience, 2019, 158: 108085.
[10] SATO N. Toward a more fundamental understanding ofcorrosion processes[J]. Corrosion science, 1989, 45(5):354-368.
[11] HUANG F, CHENG P, ZHAO X Y, et al. Effect of sulfidefilms formed on X65 steel surface on hydrogen permeationin H2S environments[J]. International journal of hydrogenenergy, 2017, 42(7): 4561-4570.
[12] TOMIO A, SAGARA M, DOI T, et al. Role of alloyedmolybdenumon corrosion resistance of austenitic Ni-Cr-Mo-Fe alloys in H2S-Cl− environments[J]. Corrosion science,2015, 98: 391-398.
[13] MIYUKI H, YAMASHITA M, FUJIWARA M, et al. Ionselective properties of rust membranes and protective effectof stable rust layer formed on weathering steel[J]. Zairyoto-kankyo,1998, 47(3): 186-192.
[14] 常煒, 胡麗華. 溫度對X65 和3%Cr 管線鋼CO2 腐蝕行為的影響[J]. 腐蝕與防護, 2012, 33(S2): 100-105.CHANG Wei, HU Li-hua. Effect of temperature on CO2corrosion behavior of X65 and 3%Cr pipeline steels[J].Corrosion and protection, 2012, 33(S2): 100-105.
[15] 楊建煒, 章軍, 曹建平, 等. 溫度對管線鋼H2S/CO2 腐蝕行為的影響[J]. 材料工程, 2011(1): 87-91.YANG Jian-jun, ZHANG Jun, CAO Jian-ping, et al. Effectof temperature on H2S/CO2 corrosion behavior of pipelinesteel[J]. Materials engineering, 2011(1): 87-91.
[16] 李國敏, 劉烈偉, 鄭家燊. 碳鋼在含硫化氫及高壓二氧化碳飽和的NaCl 溶液中的腐蝕行為[J]. 中國腐蝕與防護學報, 2000(4): 204-210.LI Guo-min, LIU Lie-wei, ZHENG Jia-shen. Corrosionbehavior of carbon steel in high pressure carbon dioxidesaturated NaCl solutions containing hydrogen sulfide[J].Journal of Chinese society for corrosion and protection,2000(4): 204-210.
[17] WANG Xin, XU Jin, SUN Cheng. Effects of sulfatereducingbacterial on corrosion of 403 stainless steel insoils containing chloride ions[J]. International journal ofelectrochemical science, 2013, 8(1): 821-830.
[18] THURMAN R B, GERBA C P, BITTON G. The molecularmechanisms of copper and silver ion disinfection ofbacteria and viruses[J]. Critical reviews in environmentalcontrol, 1989, 18(4): 295-315.
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。
-
標簽: H2S/CO2 腐蝕, 腐蝕產物, 離子選擇性, 溫度, 低合金鋼

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414