摘要
使用腐蝕失重、X射線衍射(XRD)、掃描電子顯微鏡與能譜(SEM-EDS)等手段研究了干濕交替環境中MgCl2對鋅腐蝕行為的影響。結果表明,MgCl2對鋅的腐蝕有顯著的抑制作用;在沉積NaCl條件下鋅表面的腐蝕產物為Zn5(OH)8Cl2·H2O、Zn4CO3(OH)6·H2O和Zn(OH)2,而在沉積MgCl2條件下鋅表面的腐蝕產物只有Zn5(OH)8Cl2·H2O。在干濕交替環境中MgCl2對鋅腐蝕行為的影響主要是Mg2+與氧還原反應產生的OH-結合使陰極區的pH值降低造成的。
關鍵詞: 材料失效與保護 ; 大氣腐蝕機制 ; 室內模擬加速腐蝕實驗 ; MgCl2 ; 鋅
鋅是一種用途很廣的結構金屬,其生產和消耗量都很大[1]。鋅的價格較低且具有出色的耐蝕性,主要用于防護鋼鐵材料的腐蝕。大氣腐蝕是鋅常見的一種腐蝕,是發生在薄液膜下的電化學腐蝕,因此受沉積在金屬表面的各種吸濕無機鹽類的影響[2,3,4,5,6,7]。以往大部分關于鋅在沉積各種無機鹽條件下的大氣腐蝕機制研究,大多關注Cl-離子或SO42-離子等陰離子[3,4,8,9]。其主要原因是,陰離子經常參與腐蝕產物的形成以及Cl-離子等對金屬很強的侵蝕性[10,11,12,13]。但是,陽離子對無機鹽在金屬表面的吸濕性、水解特性、表面液膜pH的影響以及參與形成腐蝕產物等因素也不可忽視。
在中國西部鹽湖地區,MgCl2是影響金屬大氣腐蝕的一種重要腐蝕介質。Wang等[14]研究了耐候鋼在中國青海鹽湖大氣環境的腐蝕演化過程,發現腐蝕產物中有特殊的含鎂腐蝕產物Mg4Fe(OH)8OCl·4H2O。這種產物因其晶體結構的特殊性能吸附Cl-離子,使耐候鋼在該環境下的耐候性降低。Wang等[15]研究2024-T3鋁合金在中國西部鹽湖大氣環境下的腐蝕行為時發現了顯著的點蝕、晶間腐蝕和應力腐蝕開裂,并發現了含鎂腐蝕產物([Mg1-xAlx(OH)2]x+Clx-·mH2O)。他們將這些腐蝕現象歸結于MgCl2·6H2O鹽類在鋁合金表面的沉積和干燥氣候。目前雖然已有關于鋅在西部鹽湖環境腐蝕行為的研究報道[16]并表明Mg2+對鋅的腐蝕有一定的影響,但是并沒有深入探討MgCl2影響鋅大氣腐蝕的機制。因為影響戶外大氣暴曬研究的因素較多,難以判斷單因素的影響作用。鑒于此,本文模擬戶外干濕交替環境研究MgCl2對鋅腐蝕行為的影響機制。
1 實驗方法
1.1 實驗用材料
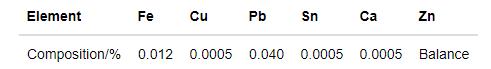
選用軋制純鋅片(純度99.9%)作為實驗材料,其成分列于表1。樣品的尺寸為50 mm×25 mm×3 mm,用砂紙將測試面充分打磨。將試樣清洗后滴上酒精吹干,在干燥箱中干燥2 d后取出并稱量其初始質量。
表1 實驗中純鋅試樣的成分(質量分數)
1.2 鋅的大氣腐蝕實驗
鑒于鋅的大氣腐蝕中最常見的腐蝕介質是NaCl[2,3,6,7,17],實驗中將NaCl作為對比實驗組的腐蝕介質,對比研究MgCl2對鋅腐蝕行為的影響機制。因為同時保持陽離子沉積速率與陰離子沉積速率相等是不可能的,將實驗分為三組:
(1) NaCl組(簡稱Na組),沉積速率為2 μmol·cm-2·d-1;
(2) MgCl2第一組(簡稱Mg1組),沉積速率為1 μmol·cm-2·d-1,Cl-離子的沉積速率與Na組Cl-離子的相同;
(3) MgCl2第二組(簡稱Mg2組),沉積速率為2 μmol·cm-2·d-1,Mg2+離子的沉積速率與Na組Na+離子的相同。
使用Weiss-Voetsch高低濕腐蝕試驗箱進行腐蝕試驗。實驗前在每個樣品的表面用微注射器沉積10 μL·cm-2的NaCl或MgCl2溶液(溶劑為水與酒精的混合液體,體積比為1:3),均勻鋪開后放在35 ℃加熱箱里將其干燥,最后將試樣水平放置在腐蝕試驗箱內進行實驗。每3 h為干濕交替的一個周期,其中濕潤1 h,濕度為80% RH,溫度為30℃;干燥2 h,濕度為20% RH,溫度為30 ℃。(由于MgCl2潮解的相對濕度為35% RH,所以干濕交替首先從濕潤過程開始。)每腐蝕24 h將試樣取出一次,并按照上述步驟進行涂鹽干燥,然后再放入試驗箱進行腐蝕實驗。總腐蝕時間為528 h。
1.3 腐蝕結果的表征
1.3.1 質量損失
去除試樣表面的腐蝕產物,使用的除銹液是將100 g NH4Cl溶解在1000 mL去離子水中制成的。質量損失的稱量:(1)先將除銹液放在恒溫水浴中加熱到70℃,然后將腐蝕試樣放入并靜置5 min;(2)將試樣取出放入盛有蒸餾水的燒杯中超聲清洗5 min;(3)將試樣取出用蒸餾水清洗后再用酒精浸潤,吹干后放入干燥器中靜置2 d。(4)將試樣從干燥器中取出用精度為0.1 mg的天平稱量,取3塊平行試樣質量損失數據的平均值。
1.3.2 XRD譜
XRD儀的型號為Rigaku-D/Max-2500PC。使用Cu靶,儀器工作參數為50 kV - 250 mA,對腐蝕表面的掃描速度為2°·min-1,掃描范圍為10°~90°。
1.3.3 SEM-EDS觀察
將用環氧樹脂封裝的試樣截面打磨到2000 #砂紙,然后用粒度為1.5 μm的金剛石拋光膏拋光。使用型號為XL30-FEG的SEM-EDS觀察分析試樣的形貌和元素分布,電子束電壓為25 kV,觀察距離約為10 mm。
2 結果和討論
2.1 腐蝕質量損失
鋅的腐蝕動力學可由腐蝕質量損失表征。為了更清晰直觀的描述腐蝕程度,用腐蝕厚度損失表示質量損失。鋅試樣的腐蝕厚度損失(μm)可表示為
![]()
式中Wt為腐蝕質量損失(g),ρ為鋅的密度(7.14 g·cm-3),S為鋅試樣的涂鹽面積。
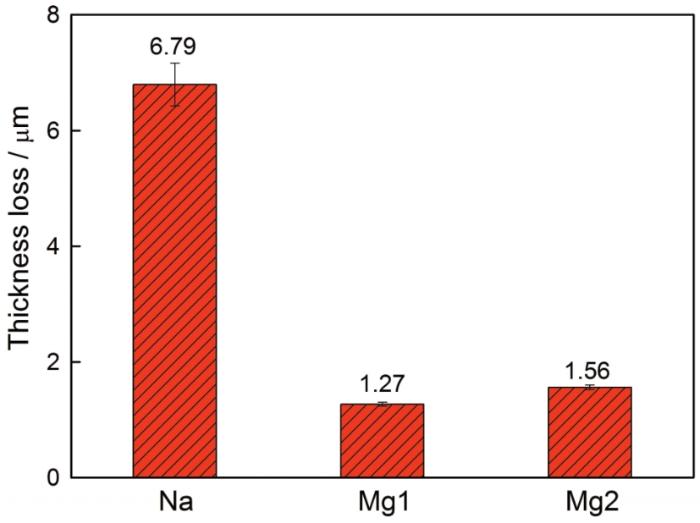
圖1 沉積不同鹽的鋅腐蝕528 h后的腐蝕失厚
圖1給出了鋅腐蝕528 h后的腐蝕質量損失。可以看出,不論是鋅在沉積等量Cl-離子的條件下,還是在沉積等量陽離子的條件下,Na組實驗中鋅的腐蝕質量損失均大于Mg組中鋅腐蝕質量損失的4倍,表明在該模擬環境下MgCl2顯著地抑制了鋅的腐蝕。圖上還可以看到,Mg2組比Mg1組鋅的腐蝕質量損失稍大,表明MgCl2的沉積速率越高鋅的腐蝕越快。
2.2 腐蝕產物
為了進一步探究MgCl2對鋅腐蝕過程的影響,對腐蝕試樣表面的腐蝕產物進行了鑒定。由于試樣表面殘留沉積的氯化鹽,進行XRD檢測前將試樣放入100 mL蒸餾水中浸泡1 min,取出后分別用蒸餾水和酒精沖洗,吹干后放入干燥器中靜置,24 h后再進行XRD分析。圖2給出了不同實驗組中鋅表面腐蝕產物的XRD譜。腐蝕產物Zn5(OH)8Cl2·H2O的最強峰位于11.2°,表明該產物在Na組、Mg1組和Mg2組中均有生成,且在Mg1組和Mg2組中Zn5(OH)8Cl2·H2O是唯一檢測到的不可溶腐蝕產物。腐蝕產物Zn4CO3(OH)6·H2O的最強峰位于12.8°,腐蝕產物Zn(OH)2的最強峰位于18.3°。Na組的XRD譜表明,除了腐蝕產物Zn5(OH)8Cl2·H2O,在鋅表面還生成了Zn4CO3(OH)6·H2O和Zn(OH)2。此外,腐蝕產物的峰形都很尖,表明其主要是晶體。
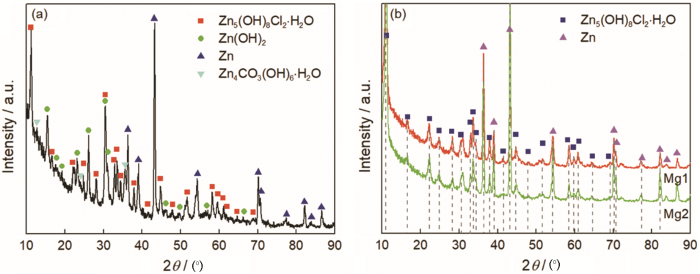
圖2 鋅腐蝕528 h后腐蝕產物的XRD譜
表2 鋅腐蝕528h后蝕產物的XRD檢測結果
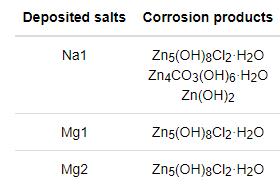
各組XRD腐蝕產物的檢測結果列于在表2。鋅在沉積NaCl條件下的腐蝕產物明顯不同于沉積MgCl2條件下的腐蝕產物,說明MgCl2抑制了腐蝕產物Zn4CO3(OH)6·H2O和Zn(OH)2的生成。
2.3 鋅腐蝕試樣的形貌
2.3.1 表面形貌
圖3給出了浸水處理后各組鋅腐蝕試樣表面的SEM照片和EDS能譜(試樣表面進行了噴碳處理,故EDS結果不能分辨含碳產物的分布情況,圖中×標記位置為EDS檢測位置)。由圖3可見,在Na組鋅試樣表面有一些山脊狀腐蝕產物(圖3a),山脊上分布一些針片狀的腐蝕產物,腐蝕產物中含有Zn、O元素(圖3c)。相對而言,Mg1組和Mg2組鋅試樣表面的腐蝕產物較平坦、分布均勻(圖3d和圖3g),表層腐蝕產物層均為針片狀(圖3e和圖3h),腐蝕產物中含有Zn、O、Cl和Mg元素(圖3f和3i)。
2.3.2 截面形貌
圖4給出了各組鋅腐蝕試樣截面形貌的SEM-EDS結果(試樣表面進行了噴碳處理,故EDS結果不能分辨含碳產物的分布情況,圖中×標記位置為EDS檢測位置)。由圖4可見,Na組腐蝕產物(圖4a)具有雙層結構,上層的腐蝕產物層呈暗灰色,下層的腐蝕產物呈現亮灰色。上層暗灰色腐蝕產物層含Zn、O 2種元素(圖4d和4e),與表面元素分析結果一致;下層亮灰色腐蝕產物層含Zn、O和Cl 3種元素。與Na組相比,Mg1組(圖4b)和Mg2組(圖4c) 的腐蝕產物為單層結構,含有Zn、O、Cl和Mg 4種元素(圖4f和4g)。
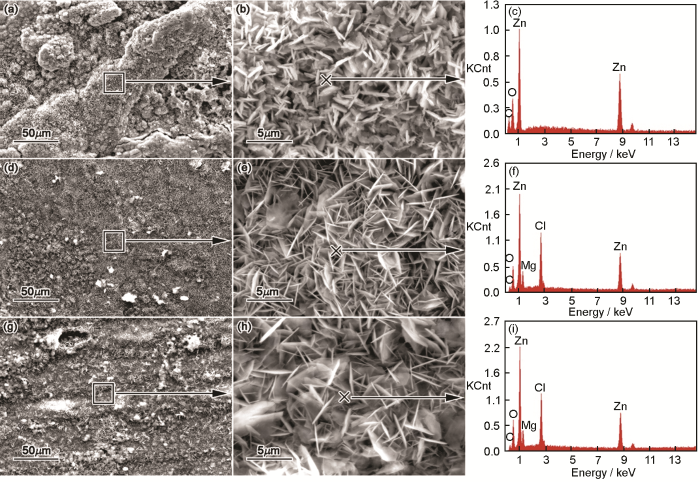
圖3 鋅腐蝕528 h后表面的SEM-EDS結果

圖4 鋅腐蝕528 h后的截面SEM-EDS結果
根據腐蝕產物的表面和截面形貌的SEM-EDS、XRD分析,在Na組中鋅試樣表面形成的腐蝕產物為雙層結構,腐蝕產物Zn(OH)2或Zn4CO3(OH)6·H2O主要分布在表層腐蝕產物中,而Zn5(OH)8Cl2·H2O主要分布在內層腐蝕產物中;與Na組不同,Mg組鋅試樣表面形成的腐蝕產物為單層結構,主要由Zn5(OH)8Cl2·H2O構成,還含有Mg元素。
2.3.3 除去腐蝕產物后的表面形貌
圖5給出了各組鋅腐蝕試樣除去腐蝕產物后表面的SEM照片。由圖5可見,在Na組鋅試樣表面有成片的點蝕坑,表明腐蝕較嚴重;而在Mg1組鋅試樣表面只有零星分布的小點蝕坑,表明腐蝕比較輕微;相對而言,Mg2組比Mg1組鋅表面點蝕坑明顯增多,點蝕坑尺寸較小且不密集,腐蝕程度居中。Na組鋅的腐蝕質量損失比Mg1組和Mg2組都大4倍以上,Mg2組比Mg1組鋅腐蝕質量損失稍大,與腐蝕形貌的結果一致。

圖5 鋅試樣表面去除腐蝕產物后的SEM照片
2.4 MgCl2對鋅大氣腐蝕機制的影響
鋅的大氣腐蝕是一個電化學腐蝕過程。其陽極反應為鋅的陽極溶解[9,18](方程2),陰極反應一般為氧還原反應[4,9](方程3):
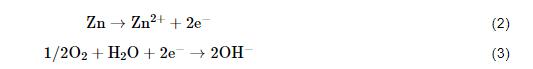
氧還原反應產生的OH-離子向陽極區遷移,鋅陽極溶解產生的Zn2+向陰極區遷移,兩者結合生成腐蝕產物Zn(OH)2。當鋅表面存在NaCl顆粒時表面液膜中的Cl-離子向陽極區遷移,反應生成腐蝕產物Zn5(OH)8Cl2·H2O(方程4):
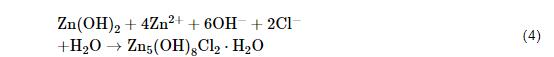
CO2是鋅大氣腐蝕時生成腐蝕產物Zn4CO3(OH)6·H2O的反應物[19,20]。CO2優先在大氣腐蝕過程中的陰極區溶解,因為它溶解生成H+,而陰極區吸氧反應生成的OH-與之中和促進更多的CO2溶解(方程5、6和7)。隨著反應的進行,在大氣腐蝕反應的陰極區Zn(OH)2轉化為Zn4CO3(OH)6·H2O(方程8):
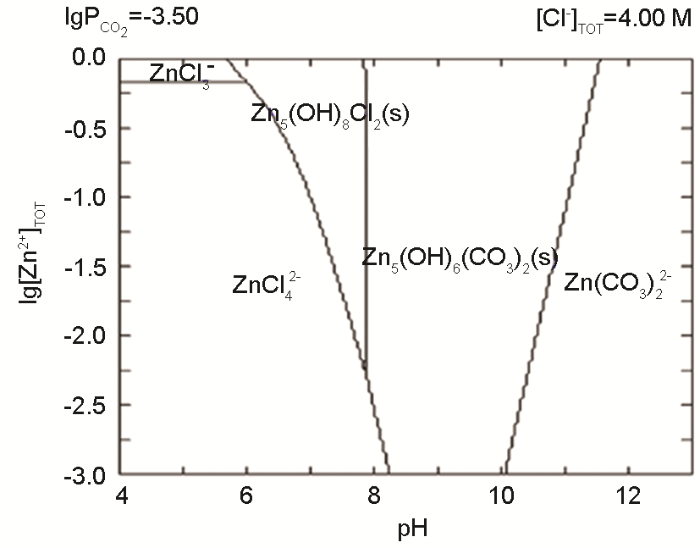
圖6 鋅的2價腐蝕產物在濃度為4 mol·L-1的Cl-離子溶液中腐蝕產物的優勢區
當鋅表面沉積MgCl2時,XRD檢測表明其表面的腐蝕產物僅為Zn5(OH)8Cl2·H2O,說明MgCl2能抑制Zn4CO3(OH)6·H2O和Zn(OH)2的生成。圖6給出了鋅二價腐蝕產物在4 mol·L-1的Cl-離子溶液中腐蝕產物的優勢區圖,其中溫度為25℃、大氣壓強為1.013×105 Pa,空氣中CO2濃度為350×10-6,Cl-離子濃度值是根據MgCl2溶液在80% RH時的理論平衡Cl-離子濃度設置的[21]。圖中用腐蝕產物Zn5(CO3)2(OH)6替代了Zn4CO3(OH)6·H2O,因為后者是前者的亞穩相,隨著時間的延長后者轉化為前者[18]。表3給出了優勢區圖計算過程中使用到的反應式及其相應的平衡常數。從圖6可見,腐蝕產物Zn5(CO3)2(OH)6的pH值比Zn5(OH)8Cl2·H2O的高,生成區間位于pH值8到11之間。因此可以認為,本文實驗中的腐蝕產物Zn4CO3(OH)6·H2O更傾向于生成在鋅大氣腐蝕時的陰極區,而腐蝕產物Zn5(OH)8Cl2·H2O更傾向于生成在鋅大氣腐蝕時的陽極區。而MgCl2液膜中的Mg2+離子易與OH-離子結合生成Mg(OH)2沉淀(方程9)降低液膜的pH值[8,18,22],從而抑制了腐蝕產物Zn4CO3(OH)6·H2O的生成。同時,pH值的下降促進了腐蝕產物Zn5(OH)8Cl2·H2O的生成。因此,在Mg1組和Mg2組鋅表面只檢測到腐蝕產物Zn5(OH)8Cl2·H2O。

圖7 腐蝕后鋅試樣浸泡液的pH值
圖7給出了鋅腐蝕試樣在100 mL蒸餾水中浸泡1 min后溶液的pH值。圖7表明,溶解Na組鋅試樣表面可溶性鹽的浸泡液其pH值較高,溶液呈弱堿性;而溶解Mg組鋅試樣表面可溶性鹽的浸泡液其pH值較低,溶液呈弱酸性。這個結果也佐證了上述推斷。但是,在腐蝕產物中并沒有檢測到Mg(OH)2,可能轉化為鋅的其他腐蝕產物[8,18,22]。
![]()
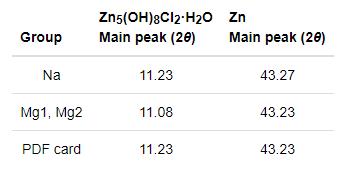
從圖8可見,Mg1組和Mg2組中腐蝕產物Zn5(OH)8Cl2·H2O的衍射峰主峰均向左發生偏移。2θ角60°到62°之間的幾處小峰也有不同程度的偏移(圖8中右上角小圖)。表4列出了腐蝕產物Zn5(OH)8Cl2·H2O和基體Zn的標準圖譜主峰位置與檢測主峰位置。由表4可知,基體Zn的衍射峰基本上沒有偏移,說明在測量過程中Na組、Mg1組和Mg2組腐蝕產物圖譜沒有發生整體偏移。但是,腐蝕產物Zn5(OH)8Cl2·H2O的衍射主峰卻向左偏移了0.15°。由布拉格衍射方程(方程10)可知,當入射X射線波長(方程10中λ)不變時,若同一組平行晶面衍射角(方程10中θ)減小,則其晶面間距(方程10中d)則相應增大。先前在Mg組腐蝕產物的XRD圖譜中只檢測到一種腐蝕產物Zn5(OH)8Cl2·H2O,但是EDS結果顯示產物中含有Mg元素。由此可以推斷,發生這種現象的原因可能是Mg原子替代了部分Zn原子進入到了腐蝕產物Zn5(OH)8Cl2·H2O中[8],使腐蝕產物Zn5(OH)8Cl2·H2O的晶格發生了畸變[22]。
表3 離子強度為0、溫度為25℃時各反應式及其相應的平衡常數[18]

![]()
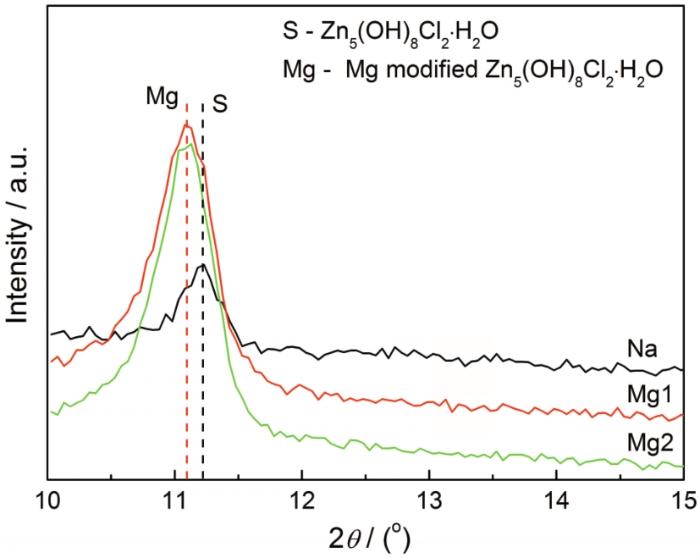
圖8 XRD譜中鋅腐蝕產物Zn5(OH)8Cl2·H2O峰的偏移
腐蝕質量損失結果表明,鋅在Na組中的腐蝕失厚是Mg1和Mg2組的4倍以上。從鹽的吸濕性角度看,MgCl2的潮解相對濕度為35% RH,NaCl的潮解相對濕度為75% RH,因此,在干濕交替過程中,在沉積MgCl2條件下鋅試樣的實際潤濕時間比在沉積NaCl條件下的鋅試樣長。單從這個角度看,沉積MgCl2的鋅的腐蝕質量損失應該大于沉積NaCl的鋅的腐蝕質量損失。但是實際上,Mg1組和Mg2組鋅的腐蝕質量損失比Na組鋅的質量損失小很多。從腐蝕產物角度分析,當鋅表面只覆蓋腐蝕產物Zn5(OH)8Cl2·H2O(有可能是“Mg式Zn5(OH)8Cl2·H2O”)時鋅的質量損失較小;而當鋅表面覆蓋有其他腐蝕產物Zn4CO3(OH)6·H2O和Zn(OH)2時鋅的質量損失是前者的4倍以上。因此,腐蝕產物Zn5(OH)8Cl2·H2O(有可能是“Mg式Zn5(OH)8Cl2·H2O”)的形成是Mg1組和Mg2組中鋅腐蝕質量損失較小的原因。
表4 不同組中腐蝕產物Zn5(OH)8Cl2·H2O的主峰位置與基體Zn主峰位置
綜上所述,于NaCl相比,在干濕交替環境中MgCl2能抑制鋅的腐蝕,其機制是:Mg2+離子能與鋅陰極氧還原反應生成的OH-離子結合生成沉淀而降低該處液膜的pH,從而促進具有保護性的腐蝕產物Zn5(OH)8Cl2·H2O(有可能是“Mg式Zn5(OH)8Cl2·H2O”)在鋅表面的均勻生成。
3 結論
(1) 不論是在沉積等量的Cl-離子條件下還是在沉積等量陽離子條件下,鋅在沉積NaCl條件下的腐蝕質量損失均是沉積MgCl2條件下的4倍以上,在干濕交替環境中MgCl2能顯著抑制鋅的腐蝕。
(2) 鋅在沉積NaCl條件下生成的腐蝕產物具有雙層結構,有Zn5(OH)8Cl2·H2O、Zn4CO3(OH)6·H2O和Zn(OH)2;而鋅在沉積MgCl2條件下生成的腐蝕產物為單層結構,只有Zn5(OH)8Cl2·H2O。
(3) MgCl2抑制鋅腐蝕的機制為:Mg2+離子與鋅陰極氧還原反應生成的OH-離子結合,生成的沉淀降低了該處液膜的pH值,從而促進了具有保護性的腐蝕產物Zn5(OH)8Cl2·H2O在鋅表面的均勻生成。
參考文獻
1 ZhangX G. Corrosion of zinc and its alloy [J]. Corros. Pro., 2006, 27(01): 41
1 章小鴿. 鋅和鋅合金的腐蝕 [J]. 腐蝕與防護, 2006, 27(01): 41
2 ChenZ Y, PerssonD, LeygrafC. Initial NaCl-particle induced atmospheric corrosion of zinc-effect of CO2 and SO2 [J]. Corros. Sci., 2008, 50(1): 111
3 ColeI S. Recent progress and required developments in atmospheric corrosion of galvanised steel and zinc [J]. Materials, 2017, 10(11): 1288
4 GraedelT E. Corrosion mechanism for zinc exposed to the atmosphere [J]. J. Electrochem. Soc., 1989, 136(4): C193
5 LiuY W, WangZ Y, CaoG W, et al. Study on corrosion behavior of zinc exposed in coastal-industrial atmospheric environment [J]. Mater. Chem. Phys., 2017, 198:243
6 NeufeldA K, ColeI S, BondA M, et al. The initiation mechanism of corrosion of zinc by sodium chloride particle deposition [J]. Corros. Sci., 2002, 44(3): 555
7 WallinderI O, LeygrafC. A critical review on corrosion and runoff from zinc and zinc-based alloys in atmospheric environments [J]. Corrosion, 2017, 73(9): 1060
8 ProsekT, ThierryD, TaxenC, et al. Effect of cations on corrosion of zinc and carbon steel covered with chloride deposits under atmospheric conditions [J]. Corros. Sci., 2007, 49(6): 2676
9 ShiY Y, ZhangZ, ZhangJ Q, et al. Review of atmospheric corrosion of zinc and zinc alloy [J]. J. Chin. Soc. Corros. Prot., 2005, 25(06): 373
9 施彥彥, 張昭, 張鑒清等. 鋅及其合金的大氣腐蝕研究現狀 [J]. 中國腐蝕與防護學報, 2005, 25(06): 373)
10 PanC, HanW, WangZ Y, et al. Evolution of initial atmospheric corrosion of carbon steel in an industrial atmosphere [J]. J. Mater. Eng. Perform., 2016, 25(12): 5382
11 HaoX H, WangZ Y, WangC. Atmospheric corrosion of zinc at Hongyanhe nuclear power station [J]. Equipm. Environ. Eng., 2012, 9(3): 108
11 郝顯赫, 王振堯, 汪川. 鋅在遼寧紅沿河核電站的大氣腐蝕研究 [J]. 裝備環境工程, 2012, 9(03): 108)
12 WangZ Y, YuG C, HanW. Atmospheric corrosion performance of zinc at several selected test sites in China [J]. Corros. Sci. Prot. Technol., 2003, 15(04): 191
12 王振堯, 于國才, 韓 薇. 我國若干典型大氣環境中的鋅腐蝕 [J]. 腐蝕科學與防護技術, 2003, 15(04): 191)
13 WangZ Y, YuG C, ZhengY P, et al. Investigation on interrelation of accelerated corrosion testing and atmospheric exposure of zinc [J]. J. Chin. Soc. Corros. Pro., 1999, 19(04): 48
13 王振堯, 于國才, 鄭逸蘋等. 鋅的加速腐蝕與大氣暴露腐蝕的相關性研究 [J]. 中國腐蝕與防護學報, 1999, 19(04): 48)
14 WangJ, WangZ Y, KeW. A study of the evolution of rust on weathering steel submitted to the Qinghai salt lake atmospheric corrosion [J]. Mater. Chem. Phys., 2013, 139(1): 225
15 WangB B, WangZ Y, HanW, et al. Atmospheric corrosion of aluminium alloy 2024-T3 exposed to salt lake environment in western China [J]. Corros. Sci., 2012, 59: 63
16 ZhangD, WangZ Y, ZhouY Z, et al. Initial corrosion behavior of galvanized steel in atmosphere by Qinghai Salt Lake [J]. Chin. J. Mater. Res., 2018, 32(04): 255
16 張 丹, 王振堯, 周永璋等. 鍍鋅鋼在青海鹽湖大氣環境下的初期腐蝕行為研究 [J]. 材料研究學報, 2018, 32(04): 255)
17 YinQ, WangZ Y, PanC. Initial corrosion behavior of pure zinc in simulated tropical marine atmosphere [J]. Trans. Nonferrous Met. Soc. China, 2018, 28(12): 2582
18 LindstromR, SvenssonJ E, JohanssonL G. The influence of salt deposits on the atmospheric corrosion of zinc - The important role of the sodium ion [J]. J. Electrochem. Soc., 2002, 149(2): B57
19 FalkT, SvenssonJ E, JohanssonL G. The influence of CO2 and NaCl on the atmospheric corrosion of zinc - A laboratory study [J]. J. Electrochem. Soc., 1998, 145(9): 2993
20 LindstromR, SvenssonJ E, JohanssonL G. The atmospheric corrosion of zinc in the presence of NaCl the influence of carbon dioxide and temperature [J]. J. Electrochem. Soc., 2000, 147(5): 1751
21 TsutsumiY, NishikataA, TsuruT. Pitting corrosion mechanism of Type 304 stainless steel under a droplet of chloride solutions [J]. Corros. Sci., 2007, 49(3): 1394
22 HoskingN C, StromM A, ShipwayP H, et al. Corrosion resistance of zinc-magnesium coated steel [J]. Corros. Sci., 2007, 49(9): 3669
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。
-
標簽: 材料失效與保護, 大氣腐蝕機制, 室內模擬加速腐蝕實驗, MgCl2, 鋅

官方微信
《中國腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網官方QQ群:140808414





