銅是所有生物體必不可少的輔助因子,但如果濃度超過進(jìn)化保守的穩(wěn)態(tài)機(jī)制維持的閾值,它就會變得有毒。銅穩(wěn)態(tài)的遺傳變異導(dǎo)致危及生命的疾病,并且銅離子載體和銅螯合劑都被建議作為抗癌劑。 然而,銅過載導(dǎo)致細(xì)胞死亡的機(jī)制一直不清楚。
2022年3月17日,哈佛醫(yī)學(xué)院Todd R. Golub團(tuán)隊(duì)在Science 在線發(fā)表題為“Copper induces cell death by targeting lipoylated TCA cycle proteins”的研究論文,該研究在人類細(xì)胞中表明,依賴于銅的、受調(diào)節(jié)的細(xì)胞死亡不同于已知的死亡機(jī)制,并且依賴于線粒體呼吸,該研究證明銅毒性的發(fā)生機(jī)制不同于所有其他已知的調(diào)節(jié)細(xì)胞死亡機(jī)制,包括細(xì)胞凋亡、鐵死亡、焦亡和壞死性凋亡,故研究人員將這種細(xì)胞死亡方式命名為——Cuprotosis(銅死亡) 。
該研究表明,銅死亡是通過銅與三羧酸 (TCA) 循環(huán)的脂酰化成分直接結(jié)合而發(fā)生的。這導(dǎo)致脂酰化蛋白質(zhì)聚集和隨后的鐵硫簇蛋白質(zhì)丟失,從而導(dǎo)致蛋白質(zhì)毒性應(yīng)激并最終導(dǎo)致細(xì)胞死亡。這些發(fā)現(xiàn)可以解釋對銅穩(wěn)態(tài)機(jī)制的需求。

銅作為必需酶的輔助因子的需求跨越動(dòng)物王國,從細(xì)菌到人體細(xì)胞已得到認(rèn)可。然而,通過跨濃度梯度起作用的主動(dòng)穩(wěn)態(tài)機(jī)制將細(xì)胞內(nèi)銅濃度保持在非常低的水平,以防止對細(xì)胞有害的游離細(xì)胞內(nèi)銅的積累。盡管其他必需金屬(如鐵)的毒性機(jī)制已經(jīng)確立,但銅誘導(dǎo)的細(xì)胞毒性機(jī)制仍不清楚。
銅離子載體是與銅結(jié)合的小分子,可將銅運(yùn)送到細(xì)胞中,因此是研究銅毒性的有用工具。多條證據(jù)表明銅離子載體誘導(dǎo)細(xì)胞死亡的機(jī)制涉及細(xì)胞內(nèi)銅的積累,而不是小分子伴侶本身的影響。銅誘導(dǎo)毒性機(jī)制不是很清楚,相互矛盾的報(bào)告表明誘導(dǎo)細(xì)胞凋亡、不依賴半胱天冬酶的細(xì)胞死亡、活性氧 (ROS)誘導(dǎo) 或抑制泛素-蛋白酶體系統(tǒng)。銅結(jié)合分子作為細(xì)胞死亡誘導(dǎo)劑的跨界功效表明它們靶向進(jìn)化上保守的細(xì)胞機(jī)制,但這種機(jī)制尚未闡明。
為了進(jìn)一步確定銅離子載體的細(xì)胞毒性是否依賴于銅本身,該研究分析了強(qiáng)效銅離子載體 elesclomol 的殺傷潛力。細(xì)胞培養(yǎng)基中銅的來源是血清,因此,在沒有血清的情況下生長的細(xì)胞對elesclomol具有抗性。相比之下,elesclomol的敏感性通過以 1:1 的比例添加銅完全恢復(fù)。銅補(bǔ)充劑同樣使細(xì)胞對六種結(jié)構(gòu)不同的銅離子載體治療敏感,但補(bǔ)充其他金屬,包括鐵、鈷、鋅和鎳,未能增強(qiáng)細(xì)胞死亡。這些結(jié)果表明銅離子載體誘導(dǎo)的細(xì)胞死亡主要依賴于細(xì)胞內(nèi)銅的積累。
該研究在人類細(xì)胞中表明,依賴于銅的、受調(diào)節(jié)的細(xì)胞死亡不同于已知的死亡機(jī)制,并且依賴于線粒體呼吸,該研究證明銅毒性的發(fā)生機(jī)制不同于所有其他已知的調(diào)節(jié)細(xì)胞死亡機(jī)制,包括細(xì)胞凋亡、鐵死亡、焦亡和壞死性凋亡,故研究人員將這種細(xì)胞死亡方式命名為——Cuprotosis(銅死亡) 。
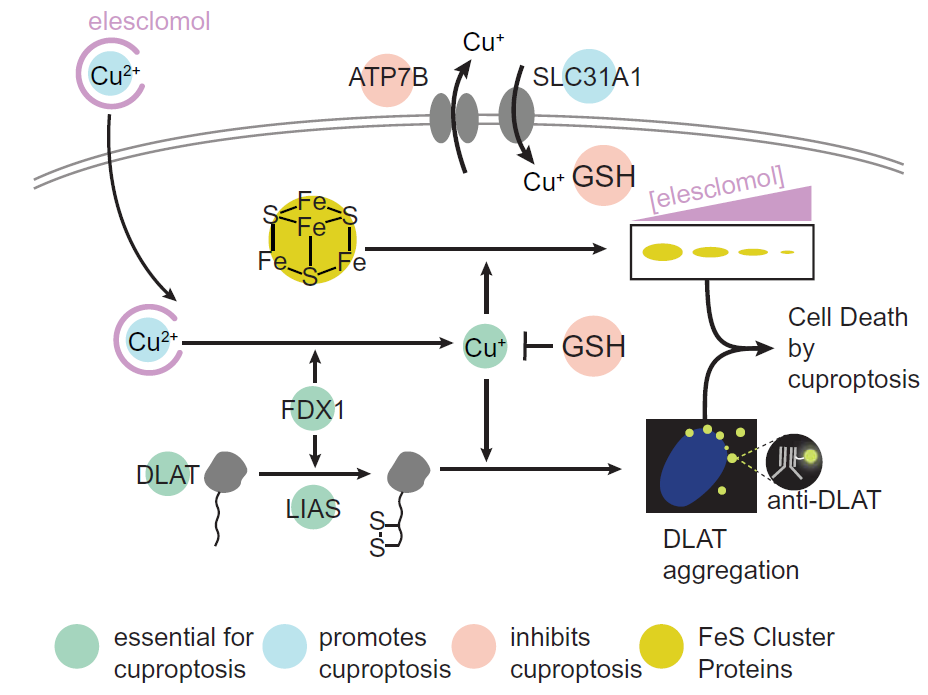
文章模式圖(圖源自Science )
該研究表明,銅依賴性死亡是通過銅與三羧酸 (TCA) 循環(huán)的脂酰化成分直接結(jié)合而發(fā)生的。 這導(dǎo)致脂酰化蛋白質(zhì)聚集和隨后的鐵硫簇蛋白質(zhì)丟失,從而導(dǎo)致蛋白質(zhì)毒性應(yīng)激并最終導(dǎo)致細(xì)胞死亡。 這些發(fā)現(xiàn)可以解釋對銅穩(wěn)態(tài)機(jī)制的需求。
參考消息: https://www.science.org/doi/10.1126/science.abf0529
免責(zé)聲明:本網(wǎng)站所轉(zhuǎn)載的文字、圖片與視頻資料版權(quán)歸原創(chuàng)作者所有,如果涉及侵權(quán),請第一時(shí)間聯(lián)系本網(wǎng)刪除。

官方微信
《中國腐蝕與防護(hù)網(wǎng)電子期刊》征訂啟事
- 投稿聯(lián)系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護(hù)網(wǎng)官方QQ群:140808414





